Soygazlar Neden Tepkimeye Girmez?
Soy gazlar tepkimeye girmez. ya da Atomlar arasında kimyasal bağ kurulurken en dış elektron kabuğundaki elektronlar bağ oluşumunda yer alır. Bunlar en temel kimya bilgilerimizden bazıları. Ancak yeni araştırmalar, bugüne kadar imkânsız olduğunu düşündüğümüz bu tepkimelerin gerçekleşebileceğini ortaya koyuyor.

Elementlerin artan atom numaralarına göre düzenlendiği periyodik tablo, elementlerin kimyasal özellikleri başta olmak üzere, aslında kimyayı anlamamızı kolaylaştırıyor. Örneğin “Bir atom neden tepkimeye girer?” sorusunun cevabını periyodik tabloda bulabiliyoruz.
Elektronlar çekirdeğin etrafında belirli enerji seviyelerinde (elektron kabukları olarak da adlandırılır) bulunur. Elementlerin birçok fiziksel ve kimyasal özelliği, sahip oldukları elektronların, kabuklarında nasıl düzenlendiğini gösteren elektron dizilimleri ile yakından bağlantılıdır. Özellikle en dış elektron kabuğundaki değerlik elektronları bir elementin kendine özgü kimyasal özelliklerini belirleyen en önemli etkendir.
Periyodik tablonun en sağındaki grupta yer alan soy gazlar elektron dizilişleri hayli kararlı olduğu için tepkimeye girme konusunda isteksizdir. En dış elektron kabuklarında mümkün olan en fazla sayıda değerlik elektronu bulunan soy gazlar dışındaki elementler ise kimyasal bağlar oluşturarak elektron dizilişlerini soy gazlara benzetmeye çalışır. Bu, kimyanın ortaya çıkış sebebidir.
1785’te İngiliz kimyacı ve fizikçi Henry Cavendish havanın çok küçük bir kısmında tepkimeye girmeden kalan bir madde olduğunu bulduktan yaklaşık yüz yıl sonra, Lord Rayleigh başlangıçta azot olduğunu düşündüğü bu gazı Sir William Ramsay ile birlikte havadan ayrıştırdı ve soy gazların periyodik tablodaki yerini belirleyen çalışmalarından dolayı 1904’te Nobel Kimya Ödülü’nü kazandılar.

Soy Gazlar Tepkimeye Girebilir mi?
Soy gazlar keşiflerinden itibaren tepkimeye girmeye isteksiz olmaları ve oluşturdukları bileşiklerin kararlı olamamasıyla tanındı. Bugün bile soy gazları bu özellikleriyle hatırlarız. Ancak so ygaz bileşiklerinin oluşabileceği ilk defa 1933’te Linus Pauling tarafından kuramsal olarak tahmin edildi ve ilk soy gaz bileşikleri 1960’lı yılların başında Neil Bartlett tarafından sentezlendi.
Aslında İngiliz kimyacı Neil Bartlett’in başlangıçtaki amacı soy gaz bileşikleri sentezlemek değildi. Bartlett, platin florür bileşikleri üzerine çalışmalar yaparken platin hekzaflorürün (PtF6) çok kuvvetli bir yükseltgen madde olduğunu, oksijeni bile yükseltgeyebildiğini keşfetti. Yükseltgen maddeler, kimyasal bir tepkimede elektron alırken yani indirgenirken elektron aldığı diğer türlerin yükseltgenmesine neden olur. Oksijen önemli bir yükseltgen madde olduğu için bu olguya adını vermiştir.
Yükseltgenme (oksitlenme) bir atom ya da molekülden elektronun ayrılması durumudur.
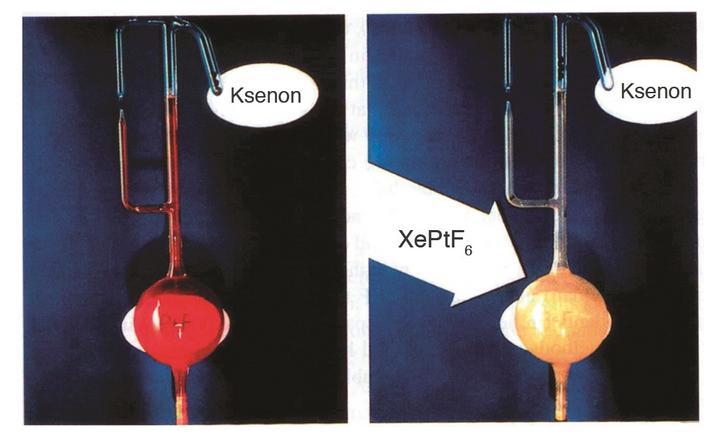
Oksijen molekülünden bir elektron almak için gerekli enerji miktarı (iyonlaşma enerjisi) ile ksenondan bir elektron almak için gerekli olan enerji miktarının birbirine çok yakın olduğuna dikkat eden Bartlett, platin hekzaflorürün ksenonu yükseltgeyebileceğini tahmin etti. Kırmızı renkli hekzaflorür gazı ile renksiz ksenonu karıştırdığında karışımın sarı renge dönüştüğünü gözlemledi. Böylece ilk soy gaz bileşiğini (XePtF6 aslında [XeF]+[Pt2F11]–) sentezlemeyi başardı.

Soy Gaz Bileşikleri Nasıl Oluşabilir?
Peki, soy gazlar elektron dizilişlerinin kazandırdığı kararlılık nedeniyle tepkimeye girmeye isteksiz olmalarına rağmen, soy gaz bileşikleri nasıl oluşabilir? Bu sorunun cevabı için hikâyenin başına dönmemiz gerekiyor.
|
Soy gaz atomlarının bu kararlı hallerini bırakıp neden bileşik oluşturdukları sorusunun cevabı aslında soy gaz bileşiklerinin hangi koşullarda oluştuğuyla ilişkilidir. Soy gaz bileşikleri, genellikle soy gaz atomlarının tepkimeye girme isteği yüksek olan atomlarla tepkimeye girmesiyle ya da yüksek basınçta oluşur. Ayrıca bu durum sadece soy gaz bileşiklerinde görülmez. Oktet kuralına uymayan başka bileşikler de vardır. |
Gilbert N. Lewis tarafından önerilen oktet kuralı, bir molekülü oluşturan atomların her birinin en dış kabuğunda (değerlik kabuğunda) sekiz elektron bulunması gerektiğini söyler. Bu hesaba atomun hem diğer atomlarla bağ yapmak için ortaklaşa kullandığı elektronlar hem de diğer değerlik elektronları dâhil edilir. En dış elektron kabuğundaki s ve p orbitalleri tam dolu olan soy gaz atomları hayli kararlıdır, bileşik oluşturduklarında ise oktet kuralını ihlal ederler.
Oktet kuralından sapan moleküllerde, genellikle d orbitallerinin bağ oluşumuna katkı sağladığı düşünülür. Ancak yapılan hesaplamalar bu katkının çok sınırlı olduğunu gösteriyor. Ronald J. Gillespie ve Bernard Silvi, Coordination Chemistry Reviews’te yayımlanan çalışmalarında oktet kuralından sapan moleküllerde, molekülü oluşturan atomların elektronları çekme isteklerinin birbirinden farklı olmasının etkili olduğunu belirtiyor.
Örneğin bir soy gaz bileşiği olan ksenon hekzaflorürde (XeF6) ksenona bağlı flor atomlarının elektronları çekme isteği yani elektronegatifliği hayli yüksektir. Gilbert N. Lewis bağ oluşumuna katılan elektronların bağı oluşturan atomlar tarafından eşit ölçüde çekildiğini söyler. Ancak elektronegatifliği hayli yüksek olan flor atomları, bağ oluşumuna katılan iki elektronu ksenona göre daha fazla çeker. Yapılan hesaplamalar bu tür moleküllerde fazladan bağ yapmış atomun en dış kabuğunda sekiz ya da sekizden az elektron bulunduğunu gösteriyor. Yani bu tür moleküller aslında oktet kuralına uyuyor.
Soy gazların kimyasının anlaşılmasının gelecekte önemli gelişmelere öncülük edebileceğini düşünen Varşova Üniversitesi’nden Wojciech Grochala, yeni elementlerin keşfi serüveninin neredeyse tamamlandığını, kimyanın artık yeni moleküller ve yeni bağlar oluşturma, atomlar arasında yeni etkileşimler kurma sanatı olduğunu söylüyor.
Değerlik Elektronları ve Kimyasal Bağlar
Profesör Grochala’nın bu öngörüsünün yanlış olduğunu söyleyemeyiz. 2013 yılının sonlarında Nature Chemistry’de yayımlanan bir çalışma kimyanın temel kurallarından birinin yıkıldığını gösteriyor. Normalde sezyum atomu, flor atomuna en dış elektron kabuğundaki bir değerlik elektronunu vererek sezyum florür bileşiğini oluşturur. Bu çalışmada ise yüksek basınç altında normalde kimyasal bağ oluşumuna katılmayan iç kabuk elektronları, farklı sezyum-flor bileşiklerinin oluşumunda kullanılıyor.

Geçtiğimiz yüzyılda kimyadaki en önemli gelişme belki de elektronların çekirdeğin etrafında belirli enerji seviyelerinde bulunduğunun keşfedilmesiydi. Elektronlar, çekirdek etrafında bulunma ihtimallerinin yüksek olduğu bölgeler olan orbitallere en düşük enerji seviyesinden başlayarak yerleşir ve bir atomdan ilk olarak en yüksek enerji seviyesindeki elektron ayrılır. Bu nedenle atomların kimyasal özellikleri atomun en dış enerji seviyesindeki elektronlar olan değerlik elektronları tarafından belirlenir. Çünkü atomlar bu elektronları kullanarak (elektron alışverişi yaparak ya da elektronlarını ortaklaşa kullanarak) kimyasal bağ oluştur. Atomların daha iç enerji kabuklarındaki elektronlar ise bağ oluşumunda yer almaz.
İç Kabuk Elektronları Bağ Oluşumunda Yer Alabilir mi?
Santa Barbara Kaliforniya Üniversitesi’nden (UCSB) araştırmacılar, yüksek basınçta atomun iç kabuklarındaki elektronların kimyasal bağların oluşumda yer aldığını gösterdi. Periyodik tablonun birinci grubunda yer alan elementlerin en dış elektron kabuğunda bir elektron bulunur ve bu elektronu vererek (bu durumda yükseltgenme basamakları +1 olur) iyonik bileşikler oluştururlar. Bu çalışmada, I. grup elementlerinden sezyumun (Cs) yüksek basınçta -5p orbitalindeki elektronlarını ortaklaşa kullanarak- yükseltgenme basamağı +1’den farklı olan bileşikler oluşturabileceği belirlendi.
Yüksek basınç, sezyumun 5p orbitalinin enerjisinin önemli miktarda artmasına neden olur. Basınç yeterince yüksek olursa 5p orbitalindeki elektronlar kuvvetli yükseltgen maddelerle kimyasal bağlar oluşturmak için kullanılabilir. Basıncın yanı sıra cıvanın oda sıcaklığında sıvı halde olmasına da (Merak Ettikleriniz, TÜBİTAK Bilim ve Teknik, Sayı 555, s.81, 2014) sebep olan görelilik etkisi –s orbitallerinin enerjisinin düşmesine ve böylece sezyumun 6s ile 5p orbitallerinin enerjisinin birbirine yaklaşmasına neden olur– iç kabuk elektronlarının bağ oluşumunda yer almasına katkı sağlar. Atom numarası yüksek (çekirdeğindeki proton sayısı fazla) elementlerin, özellikle 6. periyot elementlerinin elektronları çekirdek etrafında ışık hızıyla kıyaslanabilecek hızlarda döner. Einstein’ın özel görelilik kuramına göre bir parçacığın hızı ışık hızına yaklaştıkça etkin kütlesi artar. Bu durum orbital çapının küçülmesine ve orbitalin enerjisinin düşmesine neden olur. s orbitalleri üzerinde güçlü bir etkiye sahip olan bu etki p orbitallerini daha az etkilediği için sezyumun 6s ile 5p orbitallerinin enerjisi birbirine yaklaşır. Görelilik etkisinin d ve f orbitalleri üzerindeki doğrudan etkisi ise çok azdır.
Araştırmacılar, 5 gigapascal basınçta (Büyük Okyanus’un altında bulunan ve yerkabuğundaki en derin bölge olan Mariana Çukuru’ndaki su basıncından 50 kat daha fazla) bir değerlik elektronunun yanı sıra bir de iç kabuk elektronunun ortaklaşa kullanıldığı sezyum diflorür (CsF2) bileşiğinin kararlı olduğunu, daha yüksek basınçlarda bir değerlik elektronunun yanı sıra iki iç kabuk elektronunun ortaklaşa kullanıldığı sezyum triflorür (CsF3) ve dört iç kabuk elektronunun ortaklaşa kullanıldığı sezyum pentaflorür (CsF5) bileşiklerinin kararlı olabileceğini kuramsal olarak gösterdi. Ancak CsF4 ve CsF6 bileşiklerinin 200 gigapascal basınca kadar (yerkabuğunun manto tabakası altındaki basınca yakındır) kararlı olmadığı anlaşıldı.
Henüz laboratuvar ortamına taşınmasa da bu kuramsal çalışmaların kimyasal bağların sınırlarını zorlayarak yeni kimyasal bileşiklerin oluşturulmasına imkân verebileceği anlaşılıyor. Yani yakın zamanda okulda öğrendiğimiz kimyanın temel kurallarının yeniden yazılması gerekebilir.