Potasyum
Potasyum
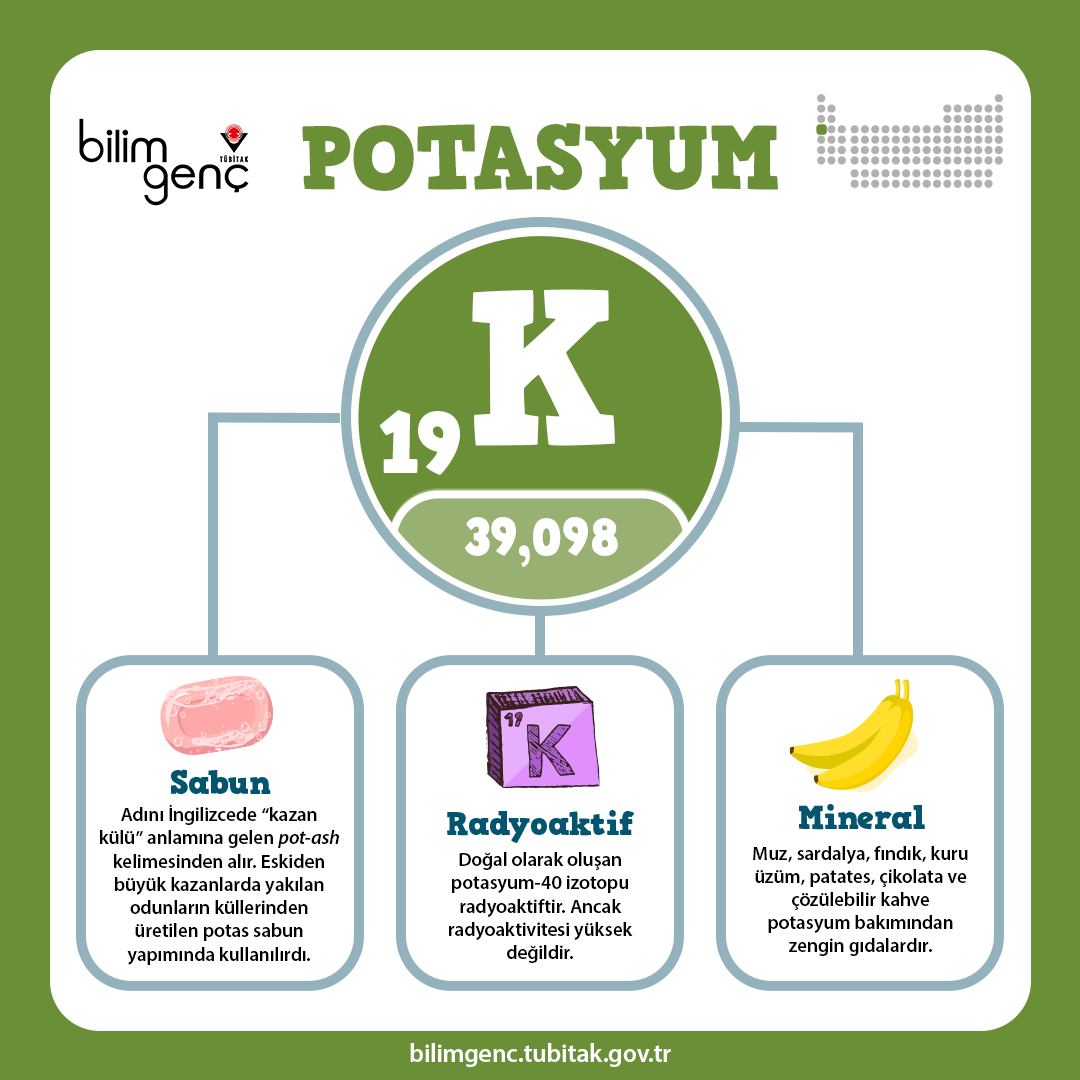
Potasyum bakımından zengin gıdalar muz, sardalya, fındık, kuru üzüm, patates, çikolata ve çözülebilir kahvedir.
Potasyum, periyodik tablonun 4. periyodunun 1. grubunda yer alan bir elementtir. Potasyumun atom numarası 19'dur. Potasyum, K sembolü ile gösterilir ve metaldir.
Potasyumun Tarihçesi ve Kullanım Alanları
Adını İngilizcede “kazan külü” anlamına gelen pot-ash kelimesinden alır. Eskiden büyük kazanlarda yakılan odunların küllerinden pot-ash, bundan da potasyum üretilir ve sabun yapımında kullanılırdı.
1807’de İngiliz kimyacı Sir Humphry Davy tarafından potas (potasyum hidroksit) tuzundan ayrıştırıldı.
Yaşam için olmazsa olmaz elementlerdendir. Bütün hücrelerde potasyum bulunur. Sıvı ve elektrolit dengesini sağlar.
Potasyum bakımından zengin gıdalar muz, sardalya, fındık, kuru üzüm, patates, çikolata ve çözülebilir kahvedir.
Bitkiler önemli potasyum kaynaklarıdır, potasyumu doğrudan topraktan alırlar. Her yıl hasat yapılan tarım arazilerinde toprağa potasyumlu gübreler karıştırmak gerekir.
Okyanuslarda potasyum tuzları da vardır ancak sodyum tuzlarına oranla bu tuzların miktarı çok düşüktür.
Doğal olarak oluşan potasyum-40 izotopu radyoaktiftir. Radyoaktivitesi yüksek olmamasına rağmen insanlardaki genetik mutasyonun doğal nedenlerinden biri olabilir.
En önemli kullanım alanı gübre sanayiidir. Nitrat, karbonat, klorür, bromür, siyanür ve sülfat iyonlarıyla oluşturduğu bileşikler de hayli önemlidir.
Potasyum karbonat cam üretiminde, potasyum hidroksit deterjan ve sıvı sabun yapımında, potasyum klorür ise ilaç yapımında ve serumlarda kullanılır.
Önemli izotopları:
39K
Elektron dizilimi:
[Ar]4s1
Yoğunluk (g/cm3):
0,89
Atom yarıçapı (Å):
2,75
Elektron ilgisi (kj/mol):
48,385
Oda sıcaklığındaki hâli:
Katı
Erime noktası (°C):
63,5
Kaynama noktası (°C):
759
Elektronegatifliği:
0,82
Keşif yılı:
1807
İyonlaşma Enerjileri
418,81
3051,83
4419,607
5876,92
7975,48
9590,6
11.342,82
14.943,65
