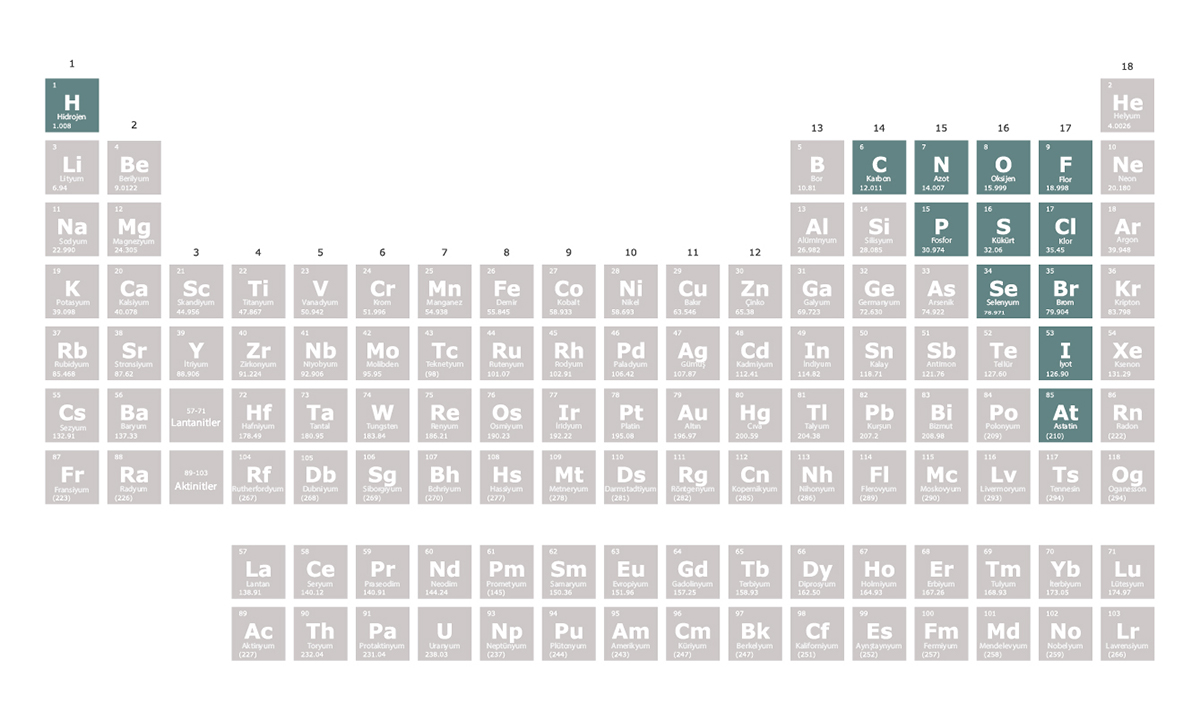
Hidrojen
Kokusuz, renksiz, tatsız ve saydam bir yapıya sahip olan hidrojen, doğadaki en hafif kimyasal elementtir.
Alkali Metaller
Periyodik tablonun ilk grubunda Hidrojen dışında yer alan metallerdir. Yumuşak ve kolay işlenebilir yapıdadırlar. En yüksek enerji seviyelerinde tek bir elektron bulunur. Bu elektronu kolayca vererek +1 yüklü iyon hâline geçerler. Kimyasal tepkimelere girmeye karşı hayli isteklidirler.
Toprak Alkali Metaller
Periyodik tablonun 2. grubunda yer alan elementlerdir. Toprak alkali metallerin en dış elektron kabuklarında iki elektron bulunur. Bu iki elektronu vererek elektron dizilimlerini soy gazlara benzetmeye çalışırlar. Bu nedenle oluşturdukları bileşiklerde +2 değerlik alırlar. Alkali metallere kıyasla tepkimeye girme istekleri daha düşüktür. Daha serttirler ve erime sıcaklıkları daha yüksektir.
Nadir Toprak Metalleri
Lantanit grubuna giren on beş element ile skandiyum ve itriyum nadir toprak metalleri olarak adlandırılır. Doğada genellikle bir arada bulunurlar ve birbirlerinden ayrıştırılmaları zordur. Adlarının ima ettiğinin aksine yer kabuğunda görece bol miktarda bulunurlar. Ancak maden cevheri biçiminde belirli bölgelerde yoğunlaşmamıştırlar, dağınık hâldedirler.
Geçiş Metalleri
Periyodik tablonun üçüncü ile on ikinci grupları arasında yer alan metallerdir. Elektron dizilimlerindeki en dış orbital her zaman d orbitalidir. Bu yüzden periyodik tablonun geçiş metallerini içeren kısmına d bloğu da denir. Bileşiklerinde değişken değerlik alırlar. Sert ve iyi iletkendirler. Saf ya da alaşım hâlinde yapı malzemesi olarak kullanılırlar.
Toprak Metalleri
Periyodik tablonun on üçüncü grubunda yer alan metallerdir. En yüksek enerji seviyelerinde üç elektron bulunur. Bileşiklerinde +3 değerlik alırlar. Grubun bu isimle anılmasının sebebi, içerdiği elementlerin oksitlerinin yer kabuğunda bol miktarda bulunmasıdır.
Halojenler
Periyodik tablonun on yedinci grubunda yer alan elementlerdir. Tamamı ametaldir. Bileşiklerinde -1 değerlik alırlar. Doğada saf olarak değil, minerallerin bileşenleri olarak bulunurlar. Elementleri iki atomlu moleküllerden oluşur. Oda koşullarında flor ve klor, gaz; brom, sıvı; iyot katı hâlde bulunur.
Soy Gazlar
Periyodik tablonun on sekizinci grubunda yer alan elementlerdir. Kimyasal tepkimelere girmeye karşı aşırı derecede isteksiz oldukları için bu adla anılırlar. Dünya’nın atmosferinde soy gazlar vardır. Sıvılaştırılmış havanın damıtılmasıyla elde edilirler.
Lantanitler
Periyodik tablonun altındaki iki satırın üst sırasında yer alan elementlerdir. Geçiş metallerinin bir alt serisini oluştururlar. Tamamı metaldir. Elektron dizilimlerindeki en son orbital f orbitalidir. Aktinitlerle birlikte periyodik tablonun f bloğunu oluştururlar. Nadir toprak metalleri olarak adlandırılan elementlerdendirler.
Aktinitler
Periyodik tablonun en alt sırasında yer alan elementlerdir. Geçiş metallerinin bir alt serisini oluştururlar. Tamamı metaldir. Elektron dizilimlerindeki en son orbital f orbitalidir. Lantanitlerle birlikte periyodik tablonun f bloğunu oluştururlar.
Metaller
Periyodik tablonun birinci ve on ikinci grupları arasında yer alan elementler ile lantanitler ve aktinitlerin tamamı metaldir. Ayrıca on üçüncü ve on altıncı gruplar arsında yer alan bazı elementler de metaldir. Isıyı ve elektriği iyi ileten, kolay işlenebilir elementlerdir. Çözeltilerde artı yüklü iyonlar (katyonlar) hâlinde bulunurlar.
Yarı metaller
Periyodik tabloda metaller ile ametaller arasında yer alırlar. Bilim insanları arasında yarı metal olarak sınıflandırılan elementlerle ilgili bir uzlaşma yoktur. Bor, silisyum, germanyum, arsenik, antimon ve tellür hemen hemen her zaman karbon, alüminyum, selenyum, polonyum ve astatin de zaman zaman yarı metal olarak sınıflandırılır. Metal, ametal karışımı özelliklere sahiptirler. Kimyasal tepkimelerde metallere karşı ametal, ametallere karşı metal gibi davranırlar.
Ametaller
Özellikleri metallere benzemeyen elementlerdir. Periyodik tablonun on dördüncü ve on yedinci grupları arasında yer alan bazı elementler ametaldir. Ayrıca bor ve silisyum gibi bazı yarı metaller de zaman zaman ametal olarak sınıflandırılır. Isıyı ve elektriği iyi iletmezler. Çözeltilerde eksi yüklü iyonlar (anyonlar) hâlinde bulunma eğilimindedirler. Canlı organizmalar neredeyse tamamen ametallerden oluşur
Üzerinde bilinen 118 elementin yer aldığı periyodik tabloyu sınıflarınızın ya da kimya laboratuvarlarınızın duvarlarında görmüşsünüzdür. Peki bütün elementlerin üzerinde sıralandığı bir tabloya neden ihtiyaç duyuldu?
Edgar Joel Ipanaque Maza/iStock
Bugüne kadar keşfedilen 118 element var. Bu elementlerin hepsini ezberlersek periyodik tabloya ihtiyacımız kalmayacağını düşünebilirsiniz. Ancak bunun doğru olduğu söylenemez. Çünkü periyodik tablo sadece tüm elementleri kapsayan bir tablo değil. Aynı zamanda her bir elementin periyodik tablodaki yeri o elementin yapısı, özellikleri ve kimyasal tepkimelerde nasıl yer alacağı konularında bilgi veriyor. Örneğin elementlerin periyodik tablodaki dizilişine bakarak özellikleri ve birbirleriyle nasıl tepkimeye gireceği hakkında fikir edinebiliyoruz.
Elementler periyodik tabloya artan atom numaralarına göre yerleştirilir. Periyodik tablodaki elementlerin her biri bir kutucukta bulunur. Bu kutucukta elementin sembolü, atom numarası ve kütle numarası yer alır. Bir elementin atom numarası, çekirdeğindeki protonların sayısına eşittir. Bir elementin kütle numarası ise çekirdeğindeki protonların ve nötronların toplam sayısına eşittir.

Olena Poliakevych / iStock
Bir elementin bütün atomlarının proton sayısı aynıdır ancak nötron sayısı farklı olabilir. Elementin nötron sayısı farklı olan türlerine izotop denir. Her izotopun kütle numarası farklıdır. Bir elementin izotopları doğada farklı oranlarda bulunabilir. Bu nedenle elementin ortalama atom kütlesi, izotoplarının doğada bulunma oranlarına göre hesaplanır yani ağırlıklı ortalaması alınır. Periyodik tabloda elementlerin kütle numaraları genellikle küsuratlı rakamlar şeklinde verilir.
Periyodik tablodaki ilk 20 element şöyle sıralanıyor: hidrojen (H), helyum (He), lityum (Li), berilyum (Be), bor (B), karbon (C), azot (N), oksijen (O) flor (F), neon (Ne), sodyum (Na), magnezyum (Mg), alüminyum (Al), silisyum (Si), fosfor (P), kükürt (S), klor (Cl), argon (Ar), potasyum (K), kalsiyum (Ca).
Bu elementler arasında, günlük hayattan aşina olduğumuz birçok element yer alıyor.
Grafik Tasarım: Erhan Balıkçı
Jonas Reuel / iStock
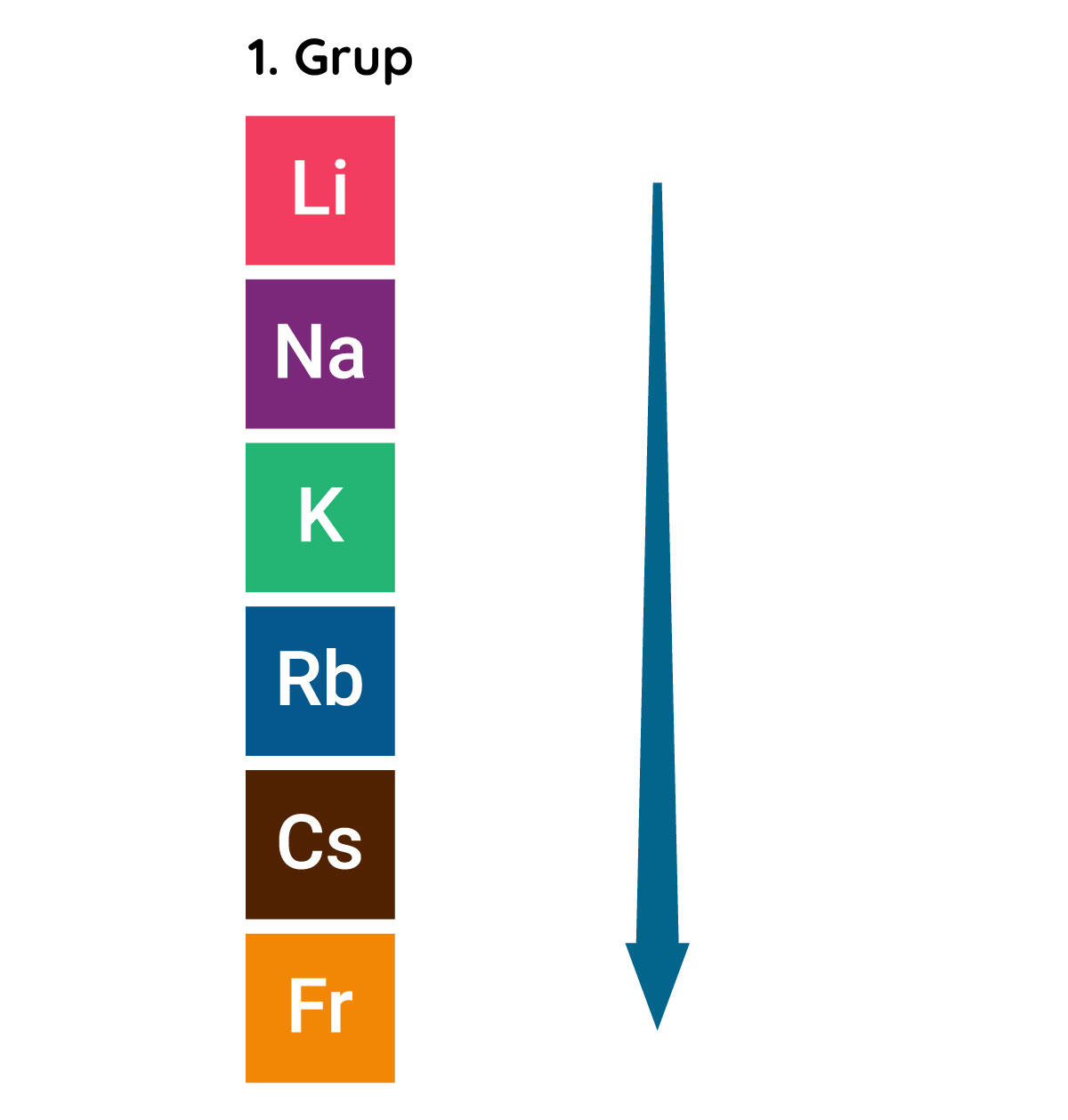
Periyodik tablodaki dikey sütunlar grup olarak isimlendirilir. Aynı gruptaki elementlerin değerlik elektronlarının sayısı aynıdır. Bu elementler benzer kimyasal özelliklere sahiptir. Örneğin 1. grupta yer alan elementler tepkimeye girmeye son derece isteklidir ve bir elektron vererek elektron dizilimlerini soy gazlara benzetmeye çalışırlar.
Uluslararası Temel ve Uygulamalı Kimya Birliği (IUPAC) tarafından tavsiye edilen kullanıma göre periyodik tablodaki gruplar 1’den 18’e kadar numaralandırılır.
Periyodik tablodaki yatay satırlar periyot olarak isimlendirilir. Aynı periyottaki elementlerin elektron kabuğu sayısı aynıdır. Periyodik tabloda yedi periyot bulunur.
Periyodik tabloda elementlerin özelliklerindeki değişimlerin nedenini anlamak için bazı kavramlar hakkında bilgi sahibi olmamız gerekiyor. Bu nedenle gelin önce orbital, elektron kabuğu, değerlik elektronu, perdeleme etkisi gibi kavramların ne anlama geldiğini açıklayalım.
Universal Images Group North America LLC / Alamy Stock Photo
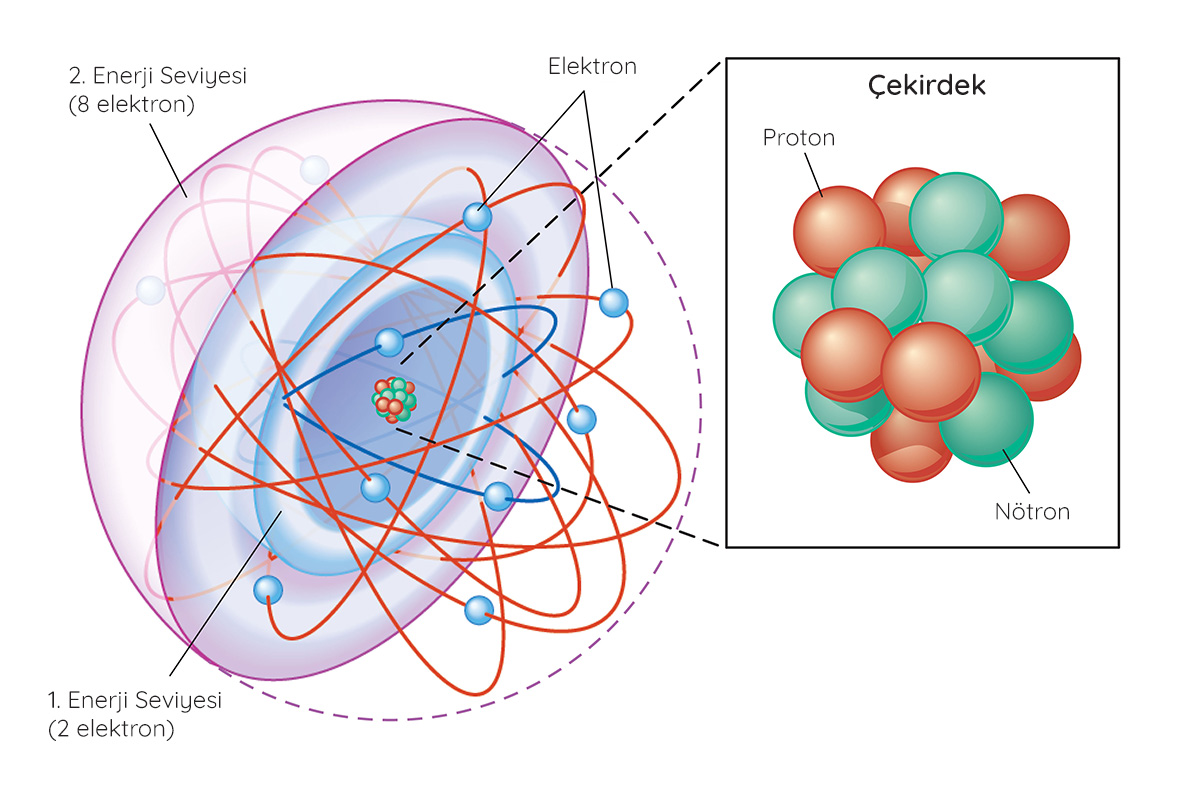
Atomlar proton, nötron ve elektronlardan oluşur. Artı yüklü protonlar ve yüksüz nötronlar atomun çekirdeğinde bulunur. Eksi yüklü elektronlarsa çekirdeğin etrafında bulunan ve elektron kabuğu olarak da adlandırılan belirli enerji seviyelerinde dolanır. En dış elektron kabuğunda bulunan elektronlar ise değerlik elektronları olarak isimlendirilir.
Universal Images Group North America LLC / Alamy Stock Photo
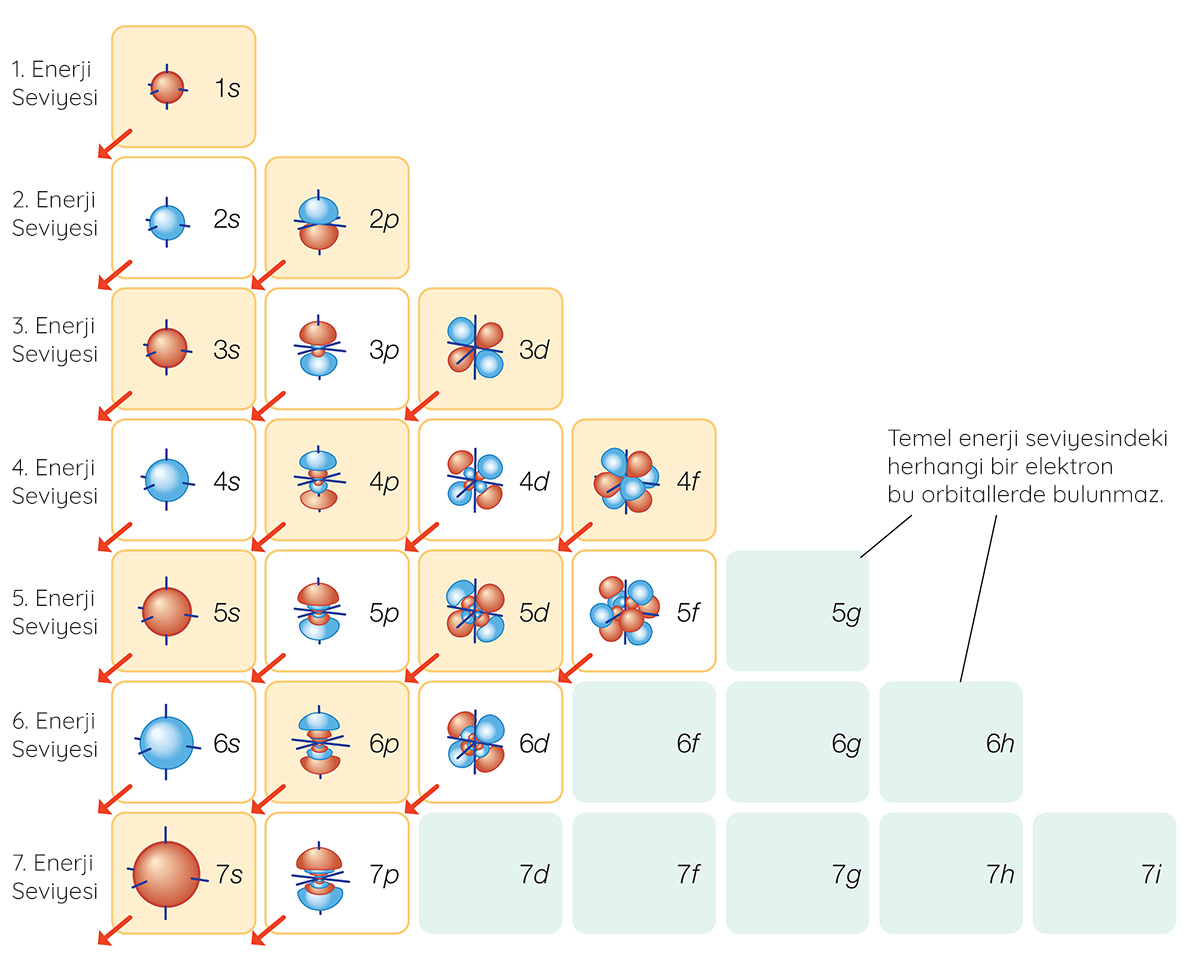
Bir atomun elektronlarının bulunma olasılıklarının yüksek olduğu bölgelere orbital denir. Spinleri birbirinden farklı olmak kaydıyla her orbitalde en fazla iki elektron bulunabilir. Elektronlar en düşük enerji seviyesinden başlayarak orbitallere yerleşir. Çekirdeğe yakın elektron kabuklarının enerjisi daha düşük, çekirdekten uzak elektron kabuklarının enerjisiyse daha yüksektir.
ttsz / iStock
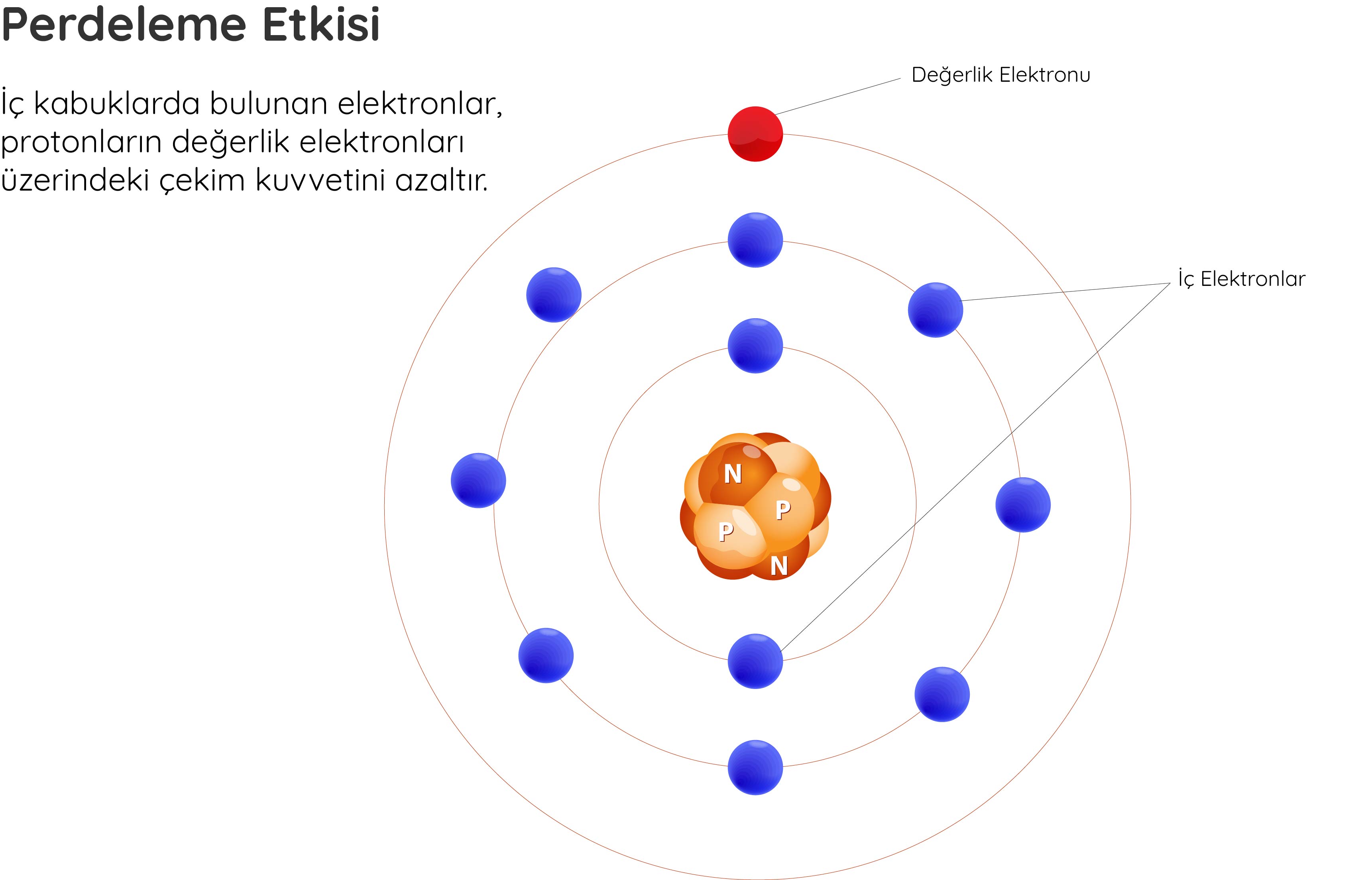
Eksi yüklü elektronlar çekirdekteki artı yüklü protonlar tarafından çekilir. Ancak atom büyüdükçe iç kabuklarda bulunan elektronlar, protonların değerlik elektronları üzerindeki çekim kuvvetini azaltır. Bu durum perdeleme etkisi olarak bilinir.
Perdeleme etkisi, çekirdekteki artı yüklü protonların en dış elektron kabuğundaki elektronları çekme kapasitesini etkiler. Elektronlar tarafından etkisi hissedilen çekirdekteki net pozitif yük etkin çekirdek yükü olarak isimlendirilir.

Alfred Pasieka / Science Photo Library
Atom yarıçapı, atomun boyutunu ifade etmek için kullanılan bir terimdir. Atomun çekirdeği ile en dış yörüngedeki elektron arasındaki mesafe olarak tanımlanabilir. Ancak bir elektronun konumunu kesin olarak belirlemek mümkün olmadığı için, atom yarıçapı, aralarında bağ olan iki atom arasındaki mesafe dikkate alınarak belirlenir.
Periyodik tablonun aynı grubunda yukarıdan aşağı doğru inildikçe atomların çekirdeklerindeki proton sayısıyla birlikte elektronların bulunduğu temel enerji seviyelerinin sayısı da artar. Bu nedenle atom çapı büyür.
Periyodik tablonun aynı periyodunda soldan sağa doğru gidildikçe atomların çekirdeklerindeki proton sayısı artarken, elektronların bulunduğu temel enerji seviyelerinin sayısı değişmez. Bu nedenle atom çapı küçülür.
Jonas Reuel / iStock
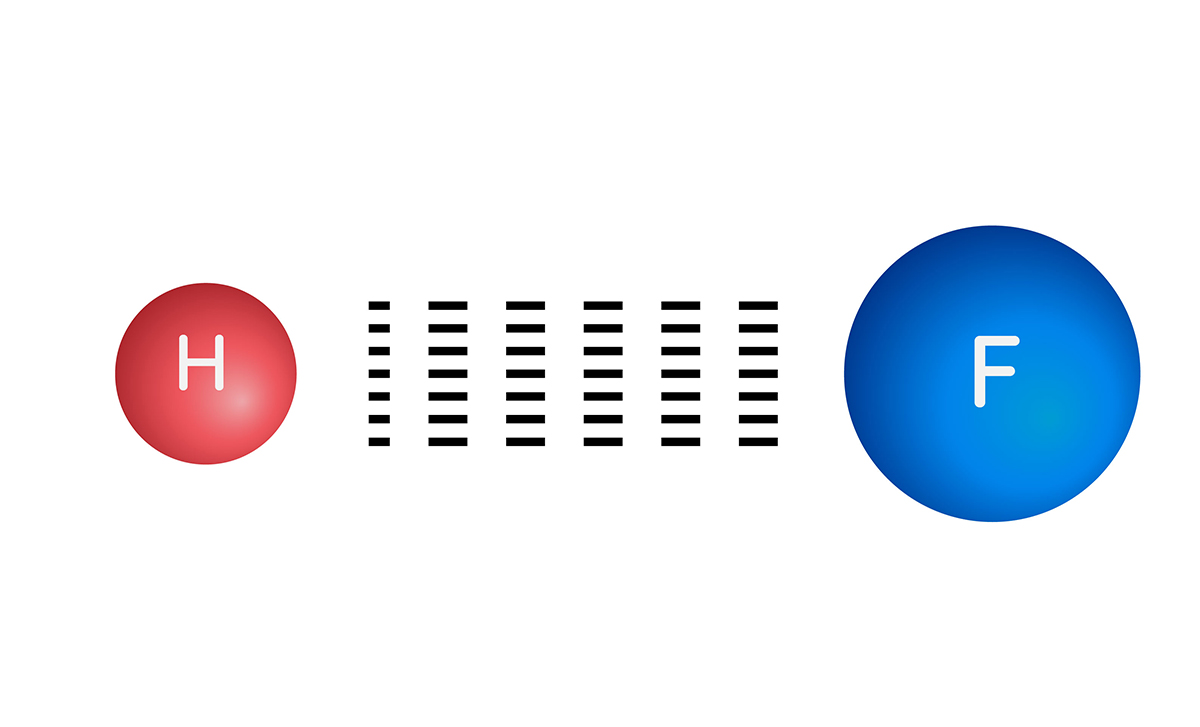
Elektronegatiflik, bir atomun kimyasal bağ oluşturan elektronları çekme kapasitesi olarak tanımlanabilir.
Periyodik tablonun sol kısmındaki atomların en dış elektron kabuğunun yarısından azı doludur. Bu atomlar elektron vererek elektron dizilimlerini soy gazlara benzetmeye ve kararlı hâle geçmeye çalışır. Bu nedenle de elektronegatiflikleri düşüktür.
Periyodik tablonun sağındaki atomların ise en dış elektron kabuklarının yarısından fazlası doludur. Bu atomlar elektron alarak elektron dizilimlerini soy gazlara benzetmeye ve kararlı hâle geçmeye çalışır. Dolayısıyla elektronegatiflikleri yüksektir.
En dış elektron kabuklarında maksimum sayıda elektron bulunduğundan yani en dış elektron kabukları tam olarak dolu olduğundan soy gazlar elektron alarak ya da elektron vererek kararlı hâllerini bozmak istemez. Bu nedenle soy gazlar, periyot boyunca elektronegatiflikteki artış trendine uymaz.
Aynı grupta yukarıdan aşağı inildikçe atom yarıçapı ve elektronların bulunduğu temel enerji seviyelerinin sayısı artar. Bu durumda hem çekirdek ile değerlik elektronlarının arasındaki mesafenin artması hem de iç elektronların perdeleme etkisi nedeniyle atomun çekirdeğindeki protonlar değerlik elektronlarını yeterince güçlü çekemez. Dolayısıyla aynı grupta yukarıdan aşağı inildikçe elektronegatiflik azalır.
Elektronegatifliği en yüksek element flor, elektronegatifliği en düşük element ise fransiyumdur.
Jonas Reuel / iStock
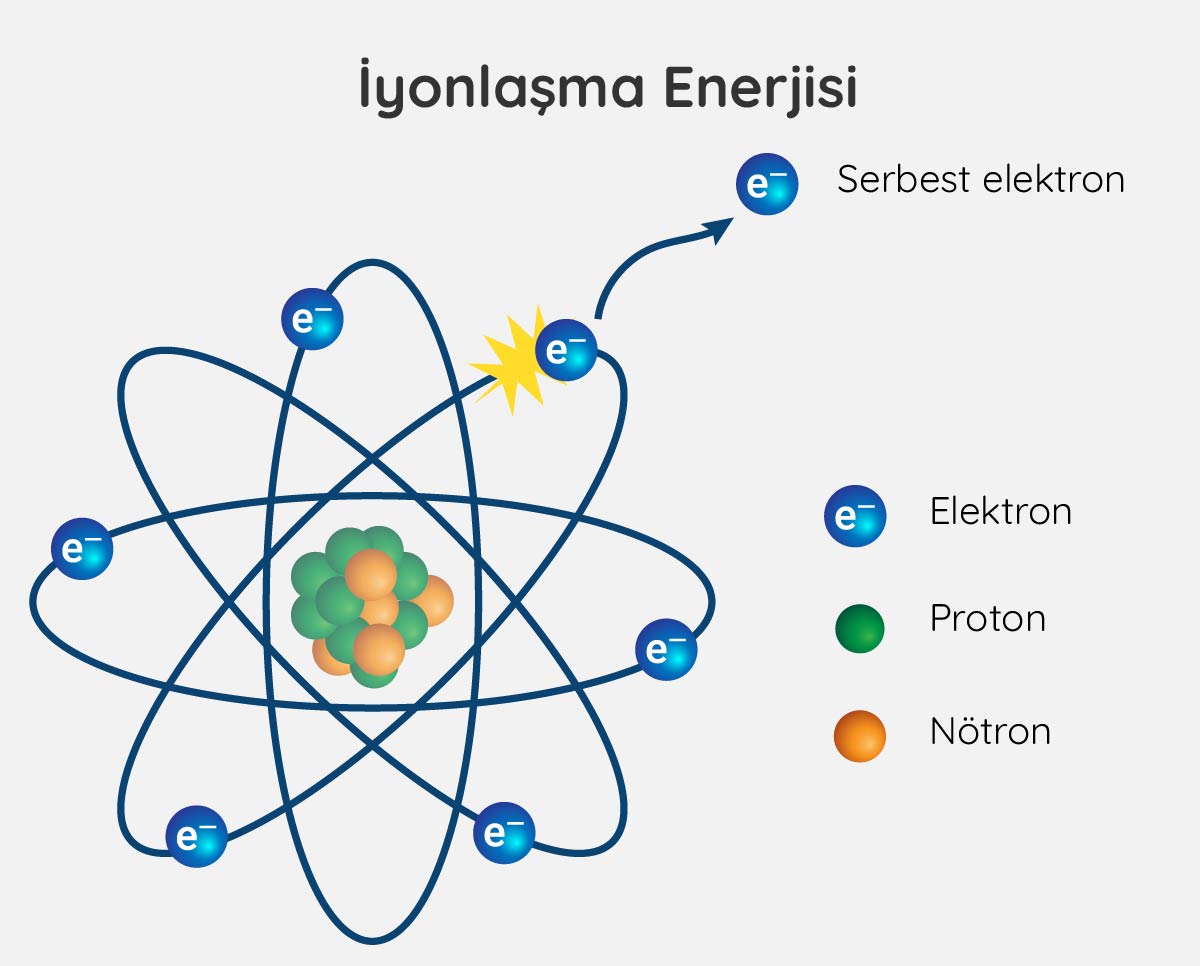
İyonlaşma enerjisi, yüksüz bir atomdan bir elektronu uzaklaştırmak için gerekli olan enerjidir.
Aynı periyotta soldan sağa doğru gidildikçe elektronların bulunduğu temel enerji seviyelerinin sayısı değişmediğinden perdeleme etkisi sabit kalır ancak etkin çekirdek yükü artar. Bu durumda en dış enerji kabuğundaki elektronlar çekirdekteki protonlar tarafından daha fazla çekilir. Dolayısıyla periyodik tablonun soluna doğru gidildikçe bir atomdan bir elektron koparmak için ihtiyaç duyulan enerji artar. Aynı periyotta bulunan elementler arasında iyonlaşma enerjisi en yüksek element soy gazdır.
Aynı grupta yukarıdan aşağı inildikçe elektronların bulunduğu temel enerji seviyelerinin sayısı arttığı ve atom yarıçapı büyüdüğü için değerlik elektronları çekirdekteki protonlar tarafından daha zayıf çekilir. Bu nedenle aynı grupta aşağı doğru inildikçe atomlardan elektron koparmak için gerekli olan enerji miktarı yani iyonlaşma enerjisi azalır.
Alkali Metaller
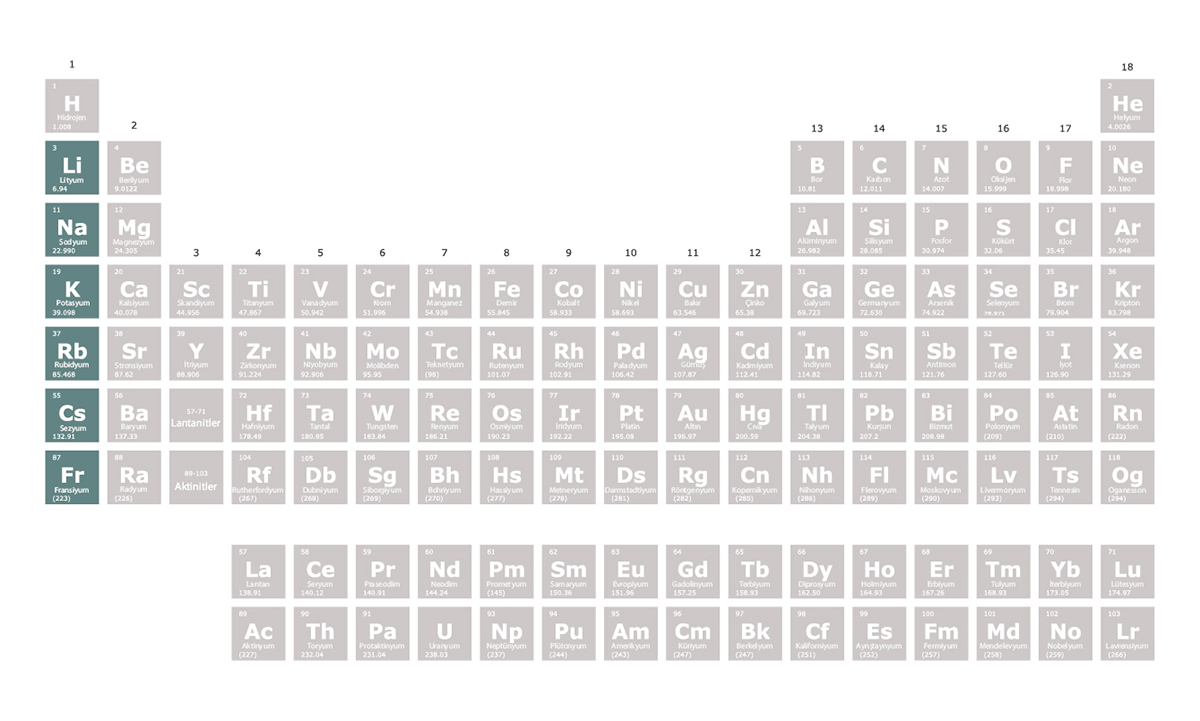
Edgar Joel Ipanaque Maza/iStock
1. grupta yer alan elementler alkali metaller olarak isimlendirilir. Alkali metaller tepkimeye girmeye son derece isteklidir. En dış kabuklarındaki bir elektronu vererek elektron dizilimlerini soy gazlara benzetmeye çalışırlar. Bu nedenle oluşturdukları bileşiklerde +1 değerliğe sahip olurlar.

Alexandre Dotta / Science Photo Library
Genellikle yumuşak ve parlak metallerdir ve erime sıcaklıkları düşüktür. Alkali metaller suyla temas ettiklerinde, hidrojen gazı ve metal hidroksit bileşiği oluşurken, ısı açığa çıkar. Açığa çıkan ısı hidrojen gazının tutuşmasını sağlar. Bu nedenle alkali metaller ve su şiddetli bir şekilde tepkimeye girer.
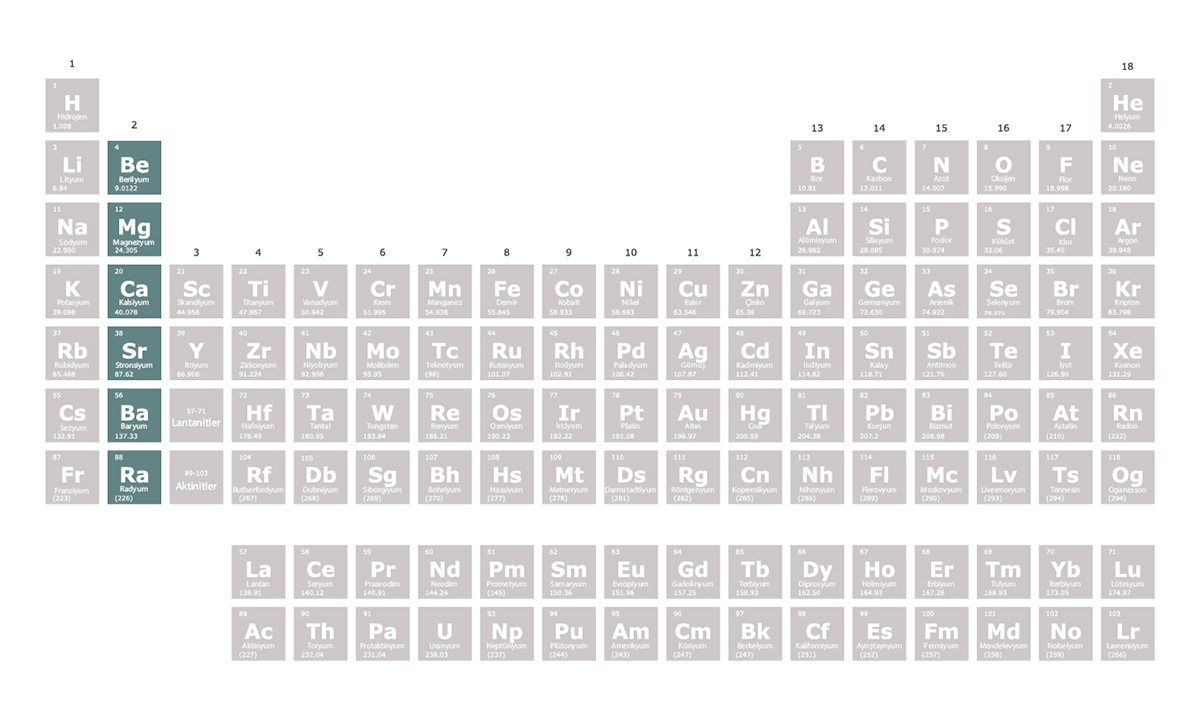
Edgar Joel Ipanaque Maza/iStock
Toprak alkali metaller, periyodik tablonun 2. grubunda yer alan elementlerdir. Toprak alkali metallerin en dış elektron kabuklarında iki elektron bulunur. Bu iki elektronu vererek elektron dizilimlerini soy gazlara benzetmeye çalışırlar. Bu nedenle oluşturdukları bileşiklerde +2 değerlik alırlar. Alkali metallere kıyasla tepkimeye girme istekleri daha düşüktür. Daha serttirler ve erime sıcaklıkları daha yüksektir.
Edgar Joel Ipanaque Maza/iStock
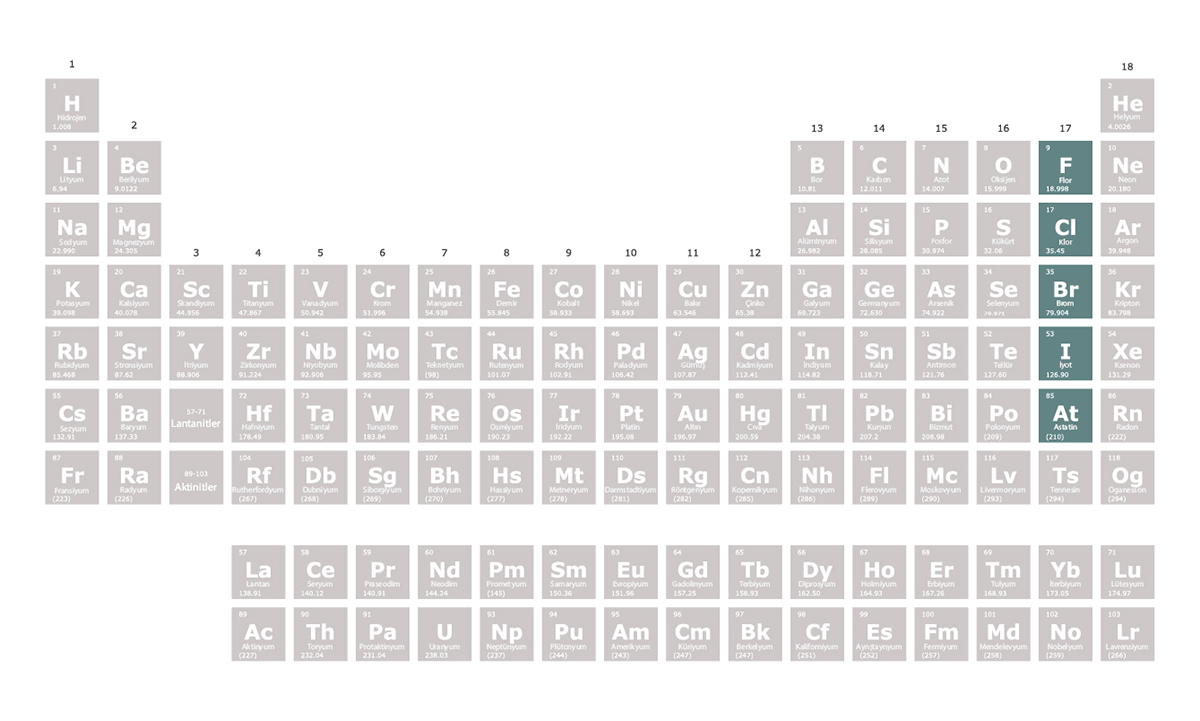
Halojenler periyodik tablonun 17. grubunda yer alan elementlerdir. En dış elektron kabuklarında 7 elektron bulunur. Halojenler bir elektron alarak elektron dizilimlerini soy gazlara benzetmeye çalışır. Bu nedenle oluşturdukları bileşiklerde -1 değerlik alırlar. Tepkimeye girme istekleri çok yüksektir. Bu nedenle doğada element hâlinde bulunmazlar. Ametaldirler yani metalik özellik göstermezler.
Halojenler metallerle iyonik bağ oluşturarak tepkimeye girer. Ametallerle kovalent bağ kurarak bileşik oluştururlar.
Halojen, “tuz oluşturan” anlamına gelir. Çünkü metallerle tepkimeye girerek tuzları oluştururlar. Örneğin evlerde kullandığımız sofra tuzu, klor elementinin sodyum ile tepkimeye girmesi sonucu oluşur.
Edgar Joel Ipanaque Maza/iStock
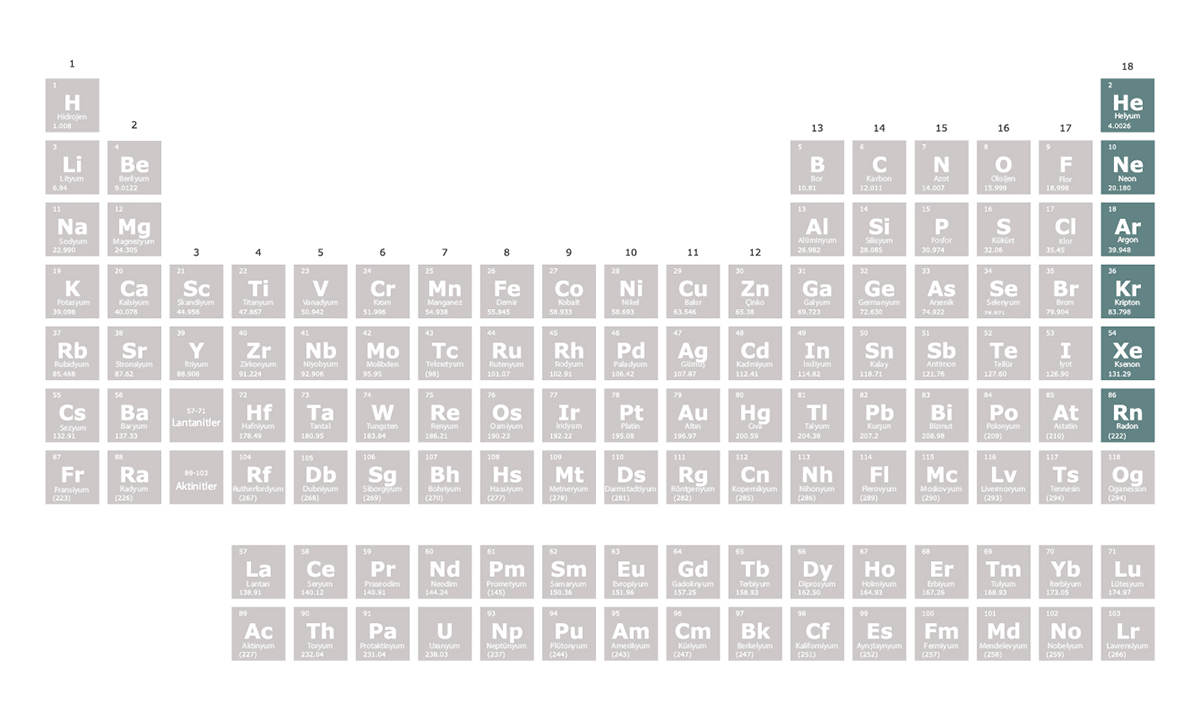
Soy gazlar, periyodik tablonun 18. grubunda yer alır. Asal gazlar olarak da bilinirler. Soy gazların en dış elektronları tamamen dolu olduğundan tepkimeye girmeye istekli değildirler. Bu nedenle soy gazlar doğada element hâlinde bulunur. Nadiren ksenon, kripton ve radon ile bileşik oluştururlar.

Edgar Joel Ipanaque Maza/iStock
Geçiş metalleri, periyodik tablonun 2. ve 13. grupları arasında yer alır. Geçiş metallerinin elektron dizilimlerindeki son orbital d orbitalidir. Geçiş elementlerinin tamamı metaldir. Geçiş metalleri bileşik oluştururken farklı sayıda elektron verebilir. Bu nedenle bileşiklerinde farklı değerlik alabilirler. Örneğin demirin doğada en yaygın bulunan bileşiklerindeki değerliği +2 ve +3’tür.
Elektron dizilimlerindeki son orbital f orbitalidir. Lantanitler ve aktinitler iç geçiş metallerini oluşturur. Tamamı metaldir.

Edgar Joel Ipanaque Maza/iStock
Lantanitler periyodik tablonun 6. periyodunda yer alan ve atom numaraları 57-71 arasında olan elementlerdir. Skandiyum ve itriyum ile birlikte nadir toprak metalleri sınıfını oluştururlar. Lantanit sınıfındaki elementler yer kabuğunda görece bol miktarda bulunur.
Edgar Joel Ipanaque Maza/iStock
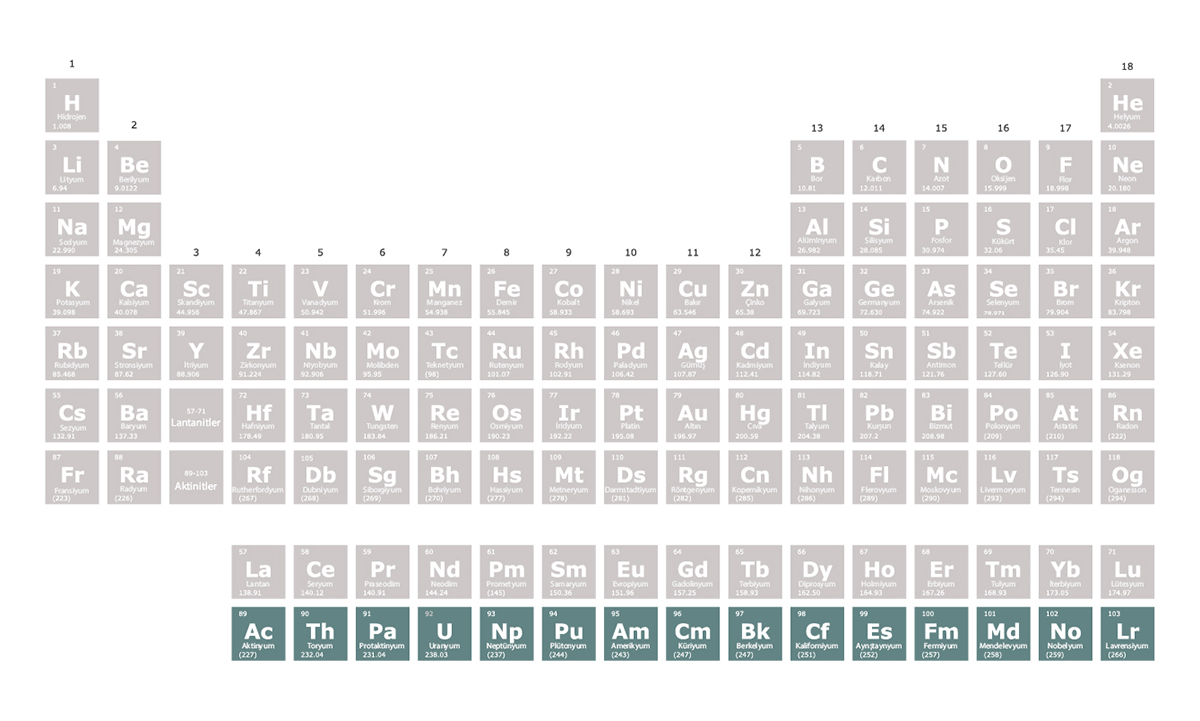
Aktinitler periyodik tablonun 7. periyodunda yer alan ve atom numaraları 89-103 arasında olan elementlerdir. Aktinitlerin tamamı radyoaktiftir. Aktinitler arasında yer alan uranyum ve plütonyum, nükleer santrallerde ve nükleer bombalarda yakıt olarak kullanılır.

Edgar Joel Ipanaque Maza/iStock
Periyodik tablonun 1. ve 12. grupları arasında yer alan metaller ile lantanitler ve aktinitlerin tamamı metaldir. Ayrıca 13. ve 16. gruplardaki bazı elementler de metaldir.
Metaller elektriği ve ısıyı iyi iletir. Örneğin gümüş ve bakır elektrik iletkenliği en yüksek olan iki elementtir. Metaller dövülerek ya da çekilerek şekillendirilebilir. Bu sayede tel ve levha hâline getirilebilirler. Örneğin altın en kolay şekillendirilebilen elementlerdendir.
Metaller çoğunlukla oda sıcaklığı ve oda basıncında katıdır. Bu koşullarda sadece cıva sıvı hâlde bulunur.
Metaller çoğunlukla parlaktır.
Edgar Joel Ipanaque Maza/iStock
Ametaller periyodik tablonun 14. ve 17. grupları arasında yer alır. Elektriği ve ısıyı iyi iletmezler. Ametaller oda sıcaklığı ve oda basıncında katı, sıvı ya da gaz hâlde bulunabilir. Örneğin periyodik tablonun 17. grubunda yer alan ametallerden flor ve klor oda sıcaklığı ve oda basıncında gaz, brom sıvı, iyot ise katı hâlde bulunur.
Katı hâldeki ametaller kırılgandır.
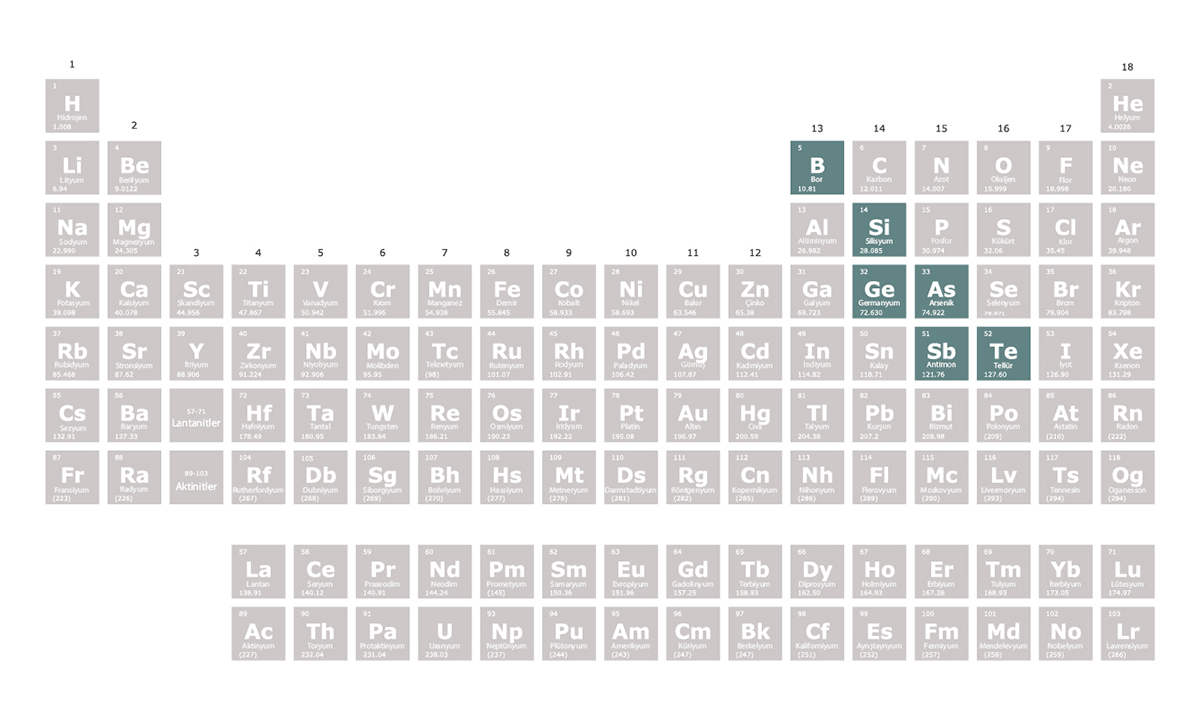
Edgar Joel Ipanaque Maza/iStock
Periyodik tablonun 13. ve 16. grupları arasında sol üstten sağ alta doğru zikzak şeklinde bir çizgi metaller ile ametalleri ayırır. Bu çizgi üzerindeki bazı elementler yarı metal olarak isimlendirilir. Yarı metaller metaloid olarak da bilinir.
Bor, silisyum, germanyum, arsenik, antimon ve tellür bilimsel kaynakların birçoğunda yarı metal olarak kabul edilir. Selenyum, polonyum ve astatini de yarı metal olarak kabul eden kaynaklar vardır.
Yarı metaller isimlerinden de anlaşılabileceği gibi metallerin ve ametallerin özelliklerini gösterebilir. Örneğin silisyum bir metal gibi parlaktır ancak bir ametal gibi kırılgandır yani dövülerek şekillendirilemez. Ayrıca çiplerin üretiminde yaygın olarak kullanılan silisyum, metallerin ve ametallerin arasında bir elektrik iletkenliği değerine sahiptir.
Peki periyodik tabloyu kim keşfetti ve periyodik tablo bugünkü hâline nasıl ulaştı? Bu soruların cevabına “Periyodik Tablo Nasıl Keşfedildi?” başlıklı yazımızdan ulaşabilirsiniz.
Kaynaklar: