Elektrikle Yazı Yazmak
Deneyler köşesinin bu etkinliğinde çeşitli kimyasal maddeler kullanarak ve elektrik devresi kurarak yazı yazarken kimyanın alt dallarından biri olan elektrokimyayı daha yakından tanıyoruz.

Derslerde not alırken bazen yazı yazmak sıkıcı ve yorucu bir hal alabilir. Peki ya elektrikle yazı yazmak? Deneyler köşesinin bu etkinliğinde çeşitli kimyasal maddeler kullanarak ve elektrik devresi kurarak yazı yazarken kimyanın alt dallarından biri olan elektrokimyayı daha yakından tanıyoruz.
Bilmekte Fayda Var!
Elektriksel ve kimyasal olaylardan oluşan iki ayrı bilim dalını birbirine bağlayan elektrokimya ile günlük hayatımızda etkileşime girmediğimiz gün neredeyse yok gibi. Örneğin pille çalışan bir cihazda ihtiyaç duyulan enerji elektrokimyasal tepkimeler sonucu elde edilir.
Elektrokimya, elektronların hareket etmesine neden olan kimyasal olayların incelendiği bilim dalıdır. Yükseltgenme-indirgenme tepkimesi olarak bilinen bir tepkimede elektronların hareketi ile elektrik üretilir. Atomun elektron vermesi yükseltgenme, elektron almasıysa indirgenme olarak isimlendirilir.
Telefonunuzun şarj olmasını ya da içinize çektiğiniz havadaki oksijenin vücudunuzda kullanılmasını sağlayan şey yükseltgenme ve indirgenme tepkimeleridir. Bu tepkimelerden yararlanılarak elektrikli arabalar, cep telefonu bataryaları, işitme cihazları, dijital saatler gibi pek çok endüstriyel ürün üretilir. Bu etkinlikte yükseltgenme-indirgenme tepkimeleri sonucu oluşan elektrik akımıyla yazı yazıyoruz.
Nelere İhtiyacımız Var?
- Potasyum iyodür
- Fenolftalein
- Nişasta
- Alüminyum folyo
- Kâğıt
- Filtre kâğıdı
- 9 V’luk pil
- 9 V’luk pil bağlantı kablosu
- 2 adet krokodil kablo
- Çay kaşığı
- Plastik bardak
Uyarı!
Etkinliğe başlamadan önce koruma gözlüğü ve eldiven takılmalı, laboratuvar önlüğü giyilmelidir.
Kimyasal maddeleri kullanırken dikkatli olunmalı, bu maddeler solunmamalı ve yutulmamalıdır.
Ne Yapıyoruz?
- Plastik bardağı yarısına kadar çeşme suyu ile dolduralım. İçine yaklaşık bir çay kaşığı nişasta ekleyelim ve iyice karıştıralım.
- Bardaktaki nişasta-su karışımının içine yaklaşık bir çay kaşığı potasyum iyodür ve bir çay kaşığı fenolftalein ekleyip karıştıralım.
- Düz bir yüzeye A4 kâğıdı boyutlarında alüminyum folyo parçası yerleştirelim. Üzerine bir tane A4 boyutunda kâğıt koyalım. Kâğıdın üzerine hazırladığımız karışımdan bir miktar dökelim ve yayılması için bekleyelim.
- Kâğıdın üzerine bir filtre kâğıdı yerleştirelim. Filtre kâğıdının üzerine de hazırladığımız karışımdan dökelim ve yayılması için bekleyelim.
- 9 V’luk pile pil bağlantı kablosunu yerleştirelim. Pil başlığının kablolarının her birine bir tane krokodil kablo takalım.
- Pilin eksi ucuna bağlı kabloyu (pil bağlantı kablosunun siyah renkli ucuna tutturulan krokodil kablo) alüminyum folyoya tutturalım.
- Pilin artı ucuna bağlı kablonun (pil bağlantı kablosunun kırmızı renkli ucuna tutturulan krokodil kablo) ucunu kalem olarak kullanıp filtre kâğıdının üzerine yazı yazalım.
- Şimdi de kabloların yerini değiştirip yazı yazmayı deneyelim. Bunun için pilin artı ucuna bağlı kabloyu alüminyum folyoya tutturalım ve pilin eksi ucuna bağlı krokodil kablonun ucunu kalem olarak kullanıp yazı yazalım.
- Ne Oldu?
Pilin eksi ucuna bağlı kabloyu alüminyum folyoya tutturup artı ucuna bağlı kabloyu filtre kâğıdına temas ettirdiğimizde kapalı bir elektrik devresi oluşur. Elektrik akımı pilin artı ucundan çıkarak çözelti, alüminyum folyo ve folyoya tutturduğumuz kablodan geçerek pilin eksi ucuna ulaşır. Pilin artı ucuna bağlı kablonun ucunu filtre kâğıdına temas ettiğimizde hazırladığımız karışım (elektrolit çözeltisi olarak isimlendirilir) elektrik akımının iletilmesini sağlar. Kalem olarak kullandığımız, pilin artı ucuna bağlı kablonun ucunda yükseltgenme tepkimesi (anot) gerçekleşir. Alüminyum folyoya tutturduğumuz, pilin eksi ucuna bağlı kablonun ucunda ise indirgenme tepkimesi (katot) gerçekleşir.
Potasyum iyodür bileşiği suda çözündüğünde artı yüklü potasyum (K+) ve eksi yüklü iyot (I-) iyonlarına ayrışır.
KI → K+ + I-
Su ise artı yüklü hidrojen (H+) ve eksi yüklü hidroksit iyonları (OH-) halindedir. Artı yüklü hidrojen iyonları ile eksi yüklü hidroksit iyonlarının sayısı birbirine eşittir.
H2O → H+ + OH-
Pilin artı ucuna bağlı kablonun ucunu kalem olarak kullandığımızda eksi yüklü iyot iyonları (I-) elektron vererek yani yükseltgenerek yüksüz haldeki iyot molekülüne (I2) dönüşür. Bu tepkimenin meydana geldiği elektrot anot olarak isimlendirilir.
2I-→ I2 + 2e-
Anotta aynı zamanda iyot dışında eksi yüklü oksijen iyonları (O2-) da elektron vererek yani yükseltgenerek oksijen molekülüne dönüşür.
2H2O → O2+ 4H++4e-
Pilin eksi ucuna bağlı kabloyu tutturduğumuz uçta artı yüklü hidrojen iyonları (H+) elektron alarak yani indirgenerek yüksüz haldeki hidrojen molekülüne (H2) dönüşür. Bu tepkimenin meydana geldiği elektrot katot olarak isimlendirilir.
2H+ + 2e-→ H2
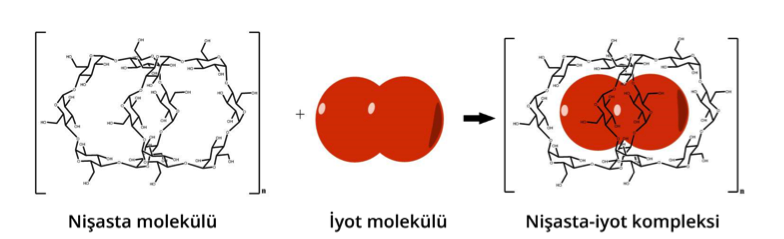
İyot nişasta ile kompleks (iyot atomlarının çevresinin nişasta molekülleri ile çevrelendiği kimyasal bir yapı) oluşturur. Nişasta-iyot kompleksinin rengi mavi-siyahtır.
Pilin artı ucuna bağlı kablonun ucunu filtre kâğıdına temas ettirdiğimiz kısımlarda mavi-siyah bir renk oluşur.
Bu nedenle filtre kâğıdının üzerine yazdığımız yazıyı renkli görürüz.
Pilin eksi ucuna bağlı kablonun ucunu kalem olarak kullandığımızdaysa artı yüklü hidrojen iyonları (H+) elektron alarak yani indirgenerek hidrojen gazını oluşturur. İndirgenme tepkimesinin meydana geldiği bu elektrot katottur.
2H+ + 2e- → H2
Pilin artı ucuna bağlı kabloyu tutturduğumuz uçta ise eksi yüklü iyot iyonu ve oksijen iyonu elektron vererek yani yükseltgenerek iyot molekülüne ve oksijen molekülüne dönüşür.
Pilin eksi ucuna bağlı kablonun ucunda artı yüklü hidrojen iyonları indirgendiğinde eksi yüklü hidroksit iyonlarının (OH-) sayısı artı yüklü hidrojen iyonlarının sayısından fazla olur. Eksi yüklü hidroksit iyonları ortamın asitlik düzeyinin düşmesine yani bazik özellik göstermesine sebep olur. Fenolftalein bir pH belirtecidir (bir maddenin asidik ya da bazik özelliğe sahip olduğunu belirlemede kullanılan kimyasal maddeler). Asit özellik gösteren ortamda renksizken ortamın asitlik düzeyi düştüğünde yani bazikleştiğinde rengi pembeye dönüşür.
Pilin eksi ucuna bağlı kablonun ucunu filtre kâğıdına temas ettirdiğimiz kısımlarda ortamın asitlik düzeyi düşer yani pH değeri artar. Fenolftaleinin rengi pembeye dönüşür. Bu nedenle filtre kâğıdının üzerine yazdığımız yazıyı pembe renkte görürüz.
Bu deneyi farklı çözeltiler ve farklı metallerden üretilen kablolar kullanarak deneyebilirsiniz.
Kaynaklar:
- Kimya, TÜBİTAK Popüler Bilim Kitapları Başvuru Kitaplığı, Ankara, 2011.
- Demiri, S. & Najdoski, M., Electrochemical writing and printing: overhead projector demonstration, Chemistry, Cilt 15, Sayı 2, 101-108, 2006.
- Nagaraj, P., Sasidharan, A., David, V. & Sambandam, A., Effect of cross-linking on the performances of starched-based biopolymer as gel electrolyte for dye-sensitized solar cell applications, Polymers, Cilt 9, Sayı 12, 2017
- https://rsc.org/learn-chemistry/resource/res00000738/electrolysis-of-...
- https://www.siyavula.com/read/science/grade-12/electrochemical-reactions/13-electrochemical-reactions-07
- https://gchem.cm.utexas.edu/echem/index.php