Kendi Pilimizi Yapalım
Deneyler köşesinin bu etkinliğinde kolay temin edebileceğiniz malzemelerle kendi pilimizi yapıyoruz.

Cep telefonu, dizüstü bilgisayar, saat ya da uzaktan kumanda… Bu cihazların hepsi enerjilerini aynı prensiple elde ediyor: kimyasal enerjinin elektrik enerjisine dönüşümü. Peki bu enerji dönüşümünü sağlayan piller nasıl çalışıyor?
Deneyler köşesinin bu etkinliğinde kolay temin edebileceğiniz malzemelerle kendi pilimizi yapıyoruz.
Bilmekte Fayda Var!
Elektrik akımı elektronlar ya da iyon gibi elektriksel olarak yüklü parçacıkların hareket etmesiyle iletilir. Pillerde elektrik akımının iletilmesini sağlayan yükler kimyasal tepkime sonucu oluşur yani elektrik enerjisi kimyasal enerjiden üretilir. Bir pilin ana bileşenleri genellikle iki farklı tür metalden yapılan iki elektrot (Katot ve anot olarak isimlendirilir.) ve elektrolit çözeltisidir. Anot yükseltgenme tepkimesinin, katot ise indirgenme tepkimesinin gerçekleştiği elektrottur. Elektrolit ise elektriksel yüklerin taşınmasını sağlayan çözeltidir.
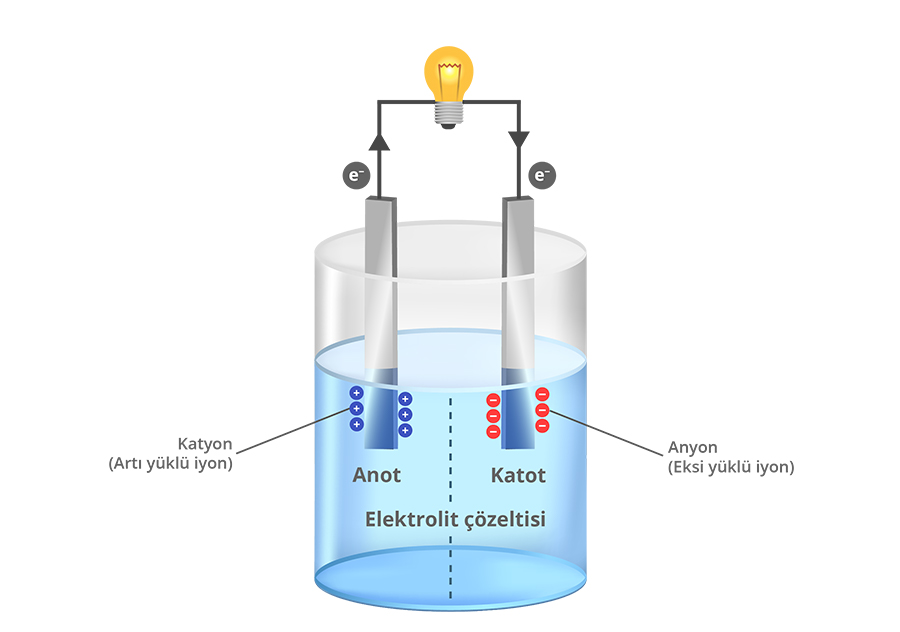
Pildeki kimyasal tepkimenin nasıl gerçekleştiğini bir benzetme ile açıklamaya çalışalım. Biri su dolu, diğeri boş iki kovanın yanlarına birer delik açtığımızı ve deliklere geçirdiğimiz boru yardımıyla bu iki kovayı birbirine bağladığımızı hayal edelim. Bağlantıyı kurduğumuzda dolu kovadaki su boş kovaya doğru hareket eder. Çünkü su yüksek potansiyel enerjili durumdan düşük potansiyel enerjili duruma doğru hareket etmek ister. Her iki kovadaki su seviyeleri aynı noktaya geldiğinde yani suyun her iki kovadaki potansiyel enerjisi eşitlendiğinde suyun akışı durur.
Pilde de anot ve katot arasındaki gerilim (potansiyel) farkı elektriksel olarak yüklü parçacıkların yani elektronların ve iyonların bir elektrottan diğerine hareket etmesini sağlar. Elektrokimyasal tepkime sırasında anotta yükseltgenme tepkimesi meydana gelir yani bir madde elektron verir ve elektronlar açığa çıkar. Katotta ise indirgenme tepkimesi meydana gelir yani bir madde elektron alır. Anot ve katodu birbirine bağlayan iletken tel ve elektrolit çözeltisi sayesinde açığa çıkan elektronlar ve iyonlar iletilebilir. Bu sayede elektrik devresi tamamlanır ve akım oluşur.

Günlük hayatta farklı türde piller kullanıyoruz. Şarj edilemeyen tek kullanımlık piller, alkalin ve çinko-karbon türleridir. Bu piller oyuncak, kumanda ve el feneri gibi aletlerde kullanılır. Bu tür pillerde anot ve katot arasındaki potansiyel farkı eşitleninceye kadar kimyasal enerji elektrik enerjisine dönüştürülür. Şarj edilebilir pillerde ise elektrik enerjisi verilerek elektrokimyasal tepkimenin tersi gerçekleştirilebilir yani pil yeniden şarj olur. Şarj edilebilen pillerin en yaygın kullanılanları lityum iyon ve nikel kadmiyum pillerdir. Bu piller otomobillerin akülerinde ve cep telefonu gibi taşınabilir elektronik cihazlarda kullanılır.
Bu etkinliğimizde kolay temin edilebilen malzemelerle kendi pilimizi yapıyoruz.
Nelere İhtiyacımız Var?
- 40 cm uzunluğunda bakır tel
- 4 adet çinko kaplı vida
- LED
- Sirke
- Buz kalıbı ya da plastik bardak
- Makas
Ne Yapıyoruz?
Ne Oldu?
Pillerin iki elektrot ve bir elektrolit çözeltisinden oluştuğunu öğrenmiştik. Kendi yaptığımız pildeki elektrotlardan biri bakır tel, diğeri çinko kaplı vidadır. Elektrolit ise sirkedir. Sirkenin yapısında asetik asit vardır, bu nedenle sirke iyi bir elektrolittir. Yaptığımız pilde çinko kaplı vida yükseltgenme tepkimesinin meydana geldiği elektrot yani anot, bakır tel ise indirgenme tepkimesinin meydana geldiği elektrot yani katot görevi görür. Bakır tellerin ve çinko kaplı vidaların olduğu bölmelere sirke ekleyip LED ile devreyi tamamlandığımızda, çinko kaplı vidalardaki çinko atomları elektron vererek yükseltgenirken artı yüklü çinko iyonları ve elektronlar açığa çıkar. Elektronlar elektrik devresi boyunca hareket ederek bakır elektroda ulaşır. Bakır elektrotta ise sirkenin içindeki artı yüklü hidrojen iyonları elektronları alarak indirgenir ve hidrojen gazı oluşur. Devrenin tamamlanmasıyla elektrokimyasal tepkimeler sonucu oluşan elektronlar devre boyunca akarak elektrik akımı oluşturur ve LED yanar.
Yaptığımız pil bir Volta pilidir. İlk pil 1800 yılında Alessandro Volta tarafından icat edilmişti. Volta, tuzlu suya batırılmış bir parça kumaş veya kartonla ayrılmış bakır ve çinko metallerinden oluşan bir devre oluşturdu ve akım üretmeyi başardı.
Limon suyu ve tuzlu su gibi farklı elektrolitler kullanarak deneyi tekrar edebilirsiniz. Bakalım LED’iniz yanacak mı? Ya da şekerli su ile deneyi tekrar ederseniz nasıl bir sonuç alırsınız?
Kaynaklar:
- https://www.britannica.com/technology/battery-electronics/Primary-batteries
- https://www.scientificamerican.com/article/charge-from-change-make-a-coin-battery/
- https://engineering.mit.edu/engage/ask-an-engineer/how-does-a-battery-work/
- https://chem.libretexts.org/Bookshelves/Analytical_Chemistry/Supplemental_Modules_(Analytical_Chemistry)/Electrochemistry/Voltaic_Cells/The_Cell_Potential
- https://sciencing.com/make-battery-coke-vinegar-8272423.html
- https://credc.mste.illinois.edu/files/resources/VinegarBatteryInstructions_2013-06-14_v2.pdf
- https://libraries.mit.edu/collections/vail-collection/topics/electricity/the-voltaic-pile/
Yazar Hakkında