Kimyasal Türler Arası Güçlü Etkileşimler: Kimyasal Bağlar
Kimyasal türler arası güçlü etkileşimler, molekülleri oluşturan atomları bir arada tutan kuvvetler yani kimyasal bağlardır.

Evrendeki tüm maddelerin atomlardan oluştuğunu biliriz. Ancak atomlar çok nadir olarak doğada tek tek bulunur. Peki atomlar neden ve nasıl kimyasal bağ oluşturur?
Kimyasal bağlar, molekülleri oluşturan atomları bir arada tutan kuvvetlerdir. Kimyasal türler arası güçlü etkileşimler olarak da isimlendirilirler. Evrendeki tüm maddelerin atomlardan oluştuğunu biliriz. Ancak atomlar çok nadir olarak doğada tek tek bulunur. Genellikle aralarında kimyasal bağlar kurarak fiziksel ve kimyasal özellikleri birbirinden farklı maddeler oluştururlar.
Peki, atomlar neden kimyasal bağ oluşturur? Aslında bu başka bir içeriğin başlığı olabilecek kadar önemli bir konu. Ancak kısaca şöyle açıklayabiliriz: Soy gazlar dışındaki elementler kimyasal bağlar oluşturarak elektron dizilimlerini soy gazlara benzetmeye ve bu sayede en kararlı hâle ulaşmaya çalışır. Bunu elektron alarak, vererek ya da elektronlarını ortaklaşa kullanarak yaparlar. Soy gazların en yüksek enerjili elektron kabuklarında mümkün olan en fazla sayıda değerlik elektronu bulunur. Bu durum nedeniyle elektron dizilimleri son derece kararlı olan soy gazlar tepkimeye girmeye isteksizdir.
Atomlar elektron vererek, alarak ya da elektronlarını ortaklaşa kullanarak kimyasal bağ oluşturabilir. Üç tür kimyasal bağ bulunur: iyonik bağ, kovalent bağ ve metalik bağ.
İyonik Bağ
İyonik bağ iki kimyasal tür arasındaki elektron alışverişine dayanır. Sonuçta eksi yüklü bir iyon olan anyon ve artı yüklü bir iyon olan katyon oluşur. Artı ve eksi yükler arasındaki elektriksel çekim kuvveti nedeniyle oluşan kimyasal bağ, iyonik bağ olarak isimlendirilir.
Jonas Reuel / iStock
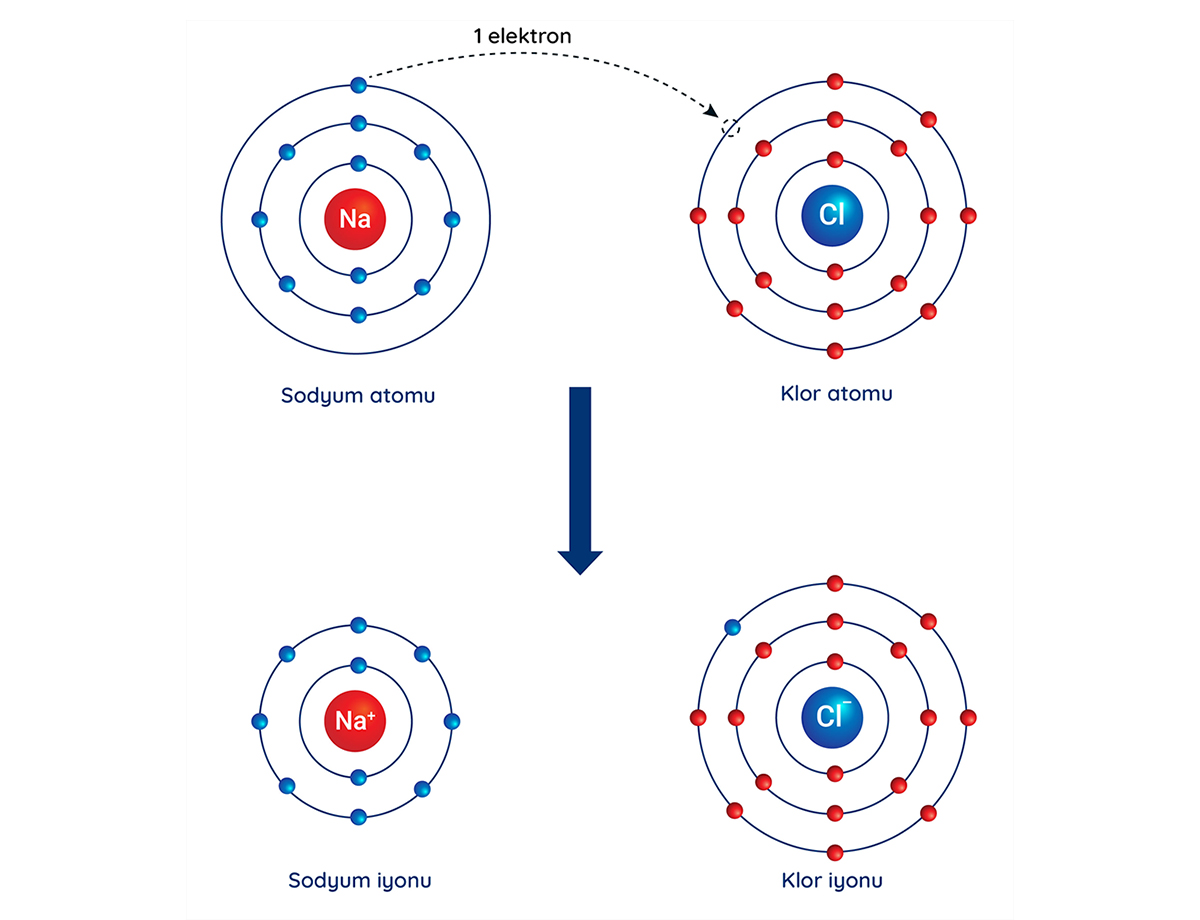
Sofra tuzu olarak bildiğimiz sodyum klorür, iyonik bir bileşiktir.
Nötr sodyum atomunun 11 elektronu ve 11 protonu vardır. En yüksek enerjili elektron kabuğu olan değerlik kabuğunda 1 elektron bulunur. Bu 1 değerlik elektronunu vererek elektron dizilimini bir soy gaz olan neonunkine (1s2 2s2 2p6) benzetmek ister.
Na: 1s2 2s2 2p6 3s1
Nötr klor atomunun 17 elektronu ve 17 protonu vardır. En yüksek enerjili elektron kabuğu olan değerlik kabuğunda 7 elektron bulunur. Klor 1 elektron alarak elektron dizilimini bir soy gaz olan argonunkine (1s2 2s2 2p6 3s2 3p6) benzetmek ister.
Cl: 1s2 2s2 2p6 3s2 3p5
Sodyum klorür molekülünde sodyum atomları 1 elektron vererek artı yüklü sodyum iyonunu (Na+) ve klor atomları 1 elektron alarak eksi yüklü klor iyonunu yani klorür anyonu (Cl-) oluşturur. Sodyum katyonu ve klorür anyonu arasındaki elektriksel çekim kuvveti nedeniyle aralarında iyonik bağ oluşur. Yani sodyum klorür iyonik bir bileşiktir.
İyonik bağı oluşturan atomların elektronegatiflikleri yani kimyasal bağa katılan elektronları çekme kapasiteleri arasında belirgin bir fark vardır. Bu nedenle iyonik bağ genellikle elektronegatifliği düşük metal atomları ile elektronegatifliği yüksek ametal atomları arasında oluşur.
Kovalent Bağ
İki atomun elektronegatiflikleri arasında belirgin bir fark olmadığında, atomlar elektronlarını ortaklaşa kullanarak elektron dizilimlerini soy gazlara benzetmeye ve kararlı hâle geçmeye çalışabilir. Elektronegatiflikleri birbirine yakın olan atomlar arasında oluşan ve elektronların ortaklaşa kullanıldığı kimyasal bağ, kovalent bağ olarak isimlendirilir.
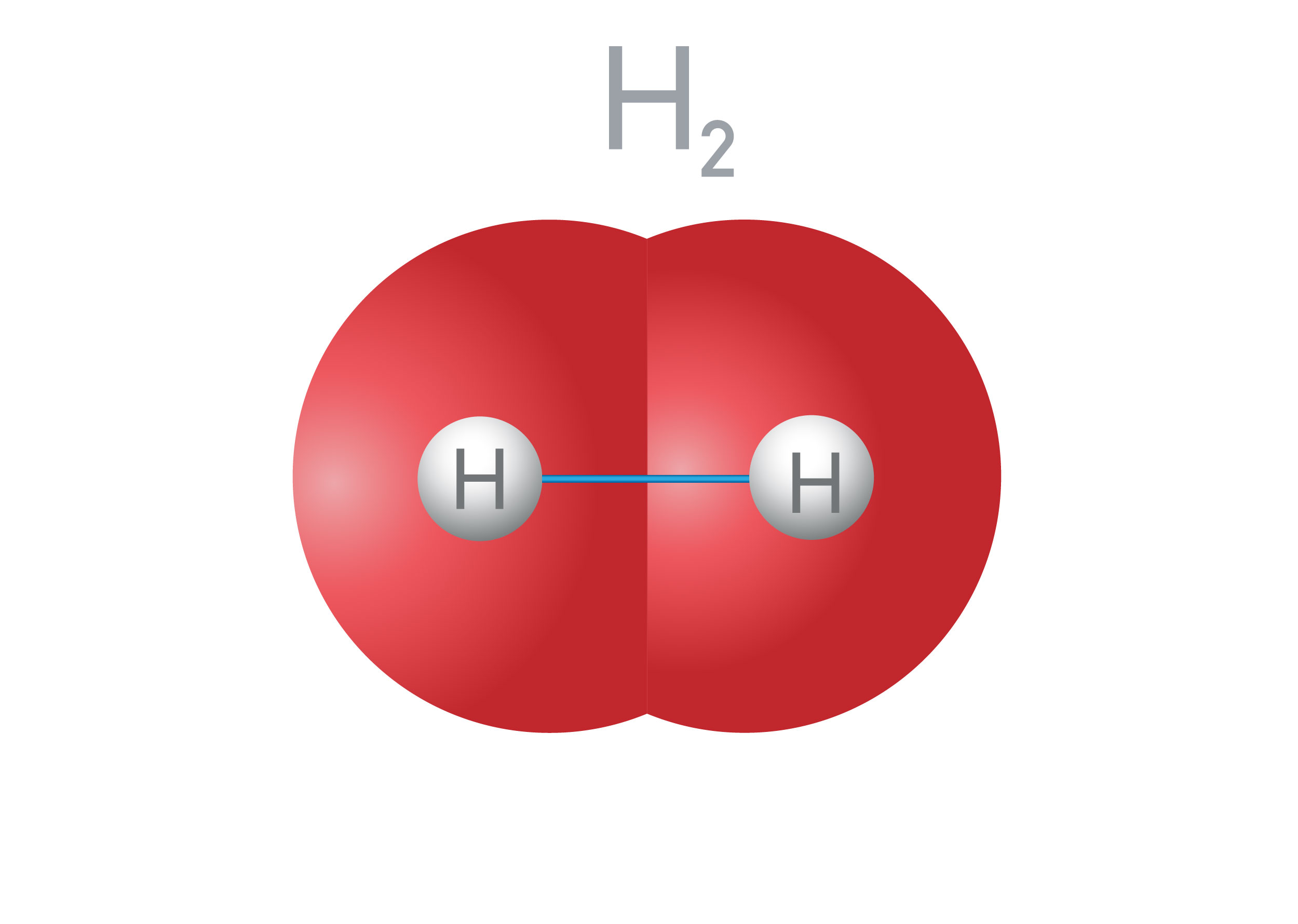
Jonas Reuel / iStock
Hidrojen molekülünde, hidrojen atomları arasında apolar kovalent bağ bulunur.
Aynı tür iki atom arasında oluşan kovalent bağ, apolar yani kutupsuz kovalent bağ olarak isimlendirilir. Örneğin hidrojen (H2) molekülünde iki hidrojen atomu elektronlarını ortaklaşa kullanarak elektron dizilimlerini bir soy gaz olan helyuma benzetmeye çalışır. Apolar kovalent bağda atomların elektronegatiflikleri aynı olduğundan, bağ oluşumuna katılan elektronlar atomlar tarafından eşit miktarda çekilir. Bu nedenle molekülde elektriksel yüklerin dağılımı dengelidir.
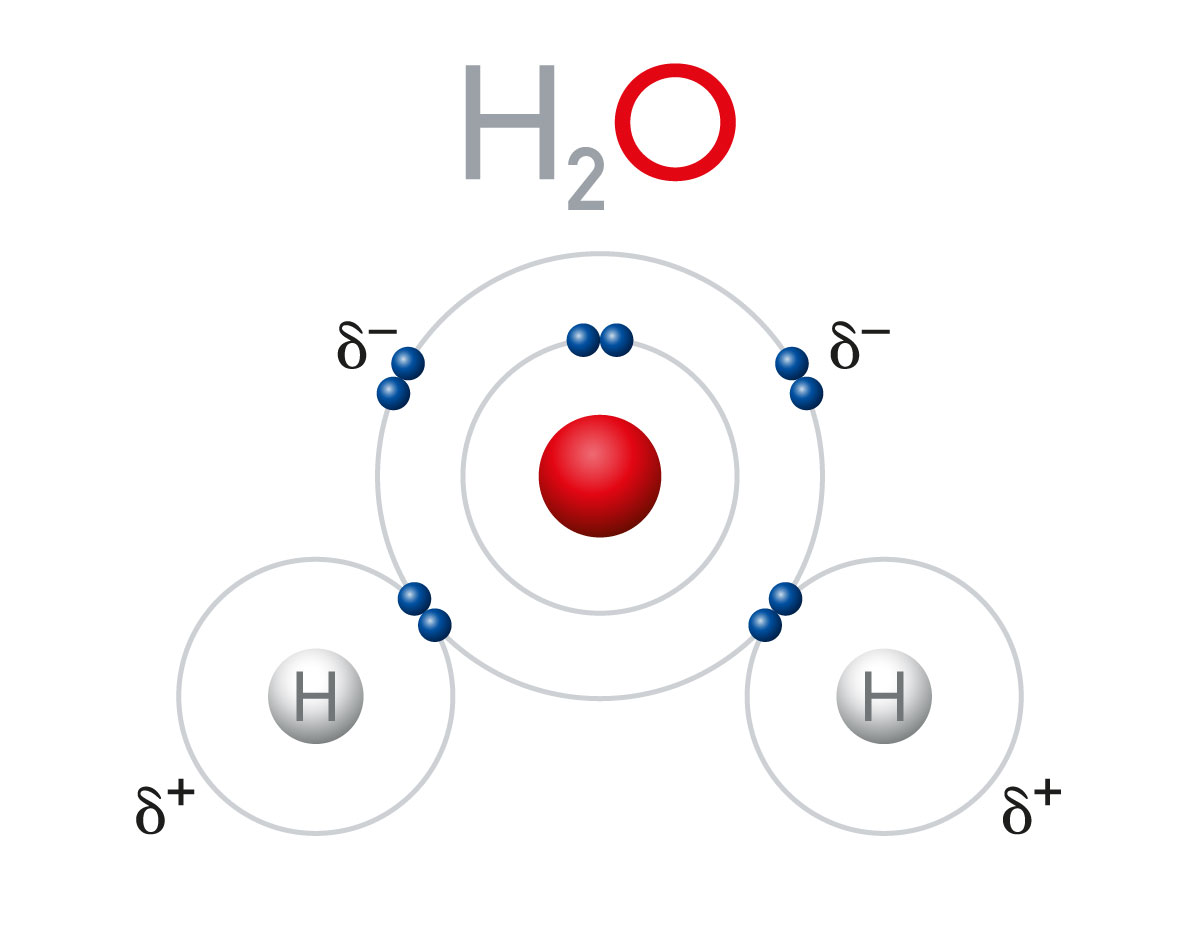
PeterHermesFurian / iStock
Su molekülünü oluşturan hidrojen ve oksijen atomları arasında polar kovalent bağ vardır.
Elektronegatiflikleri arasında küçük bir fark bulunan iki atom arasında oluşan kovalent bağ, polar yani kutuplu kovalent bağ olarak isimlendirilir. Örneğin su molekülünde oksijenin elektronegatifliği hidrojeninkinden büyüktür. Su molekülünde hidrojen ve oksijen tarafından ortaklaşa kullanılan bağ elektronları oksijen tarafından daha fazla çekildiği için oksijen atomları kısmen eksi, hidrojen atomları ise kısmen artı yükle yüklenir. Bu nedenle su molekülü polar yani kutuplu bir moleküldür.
Metalik Bağ
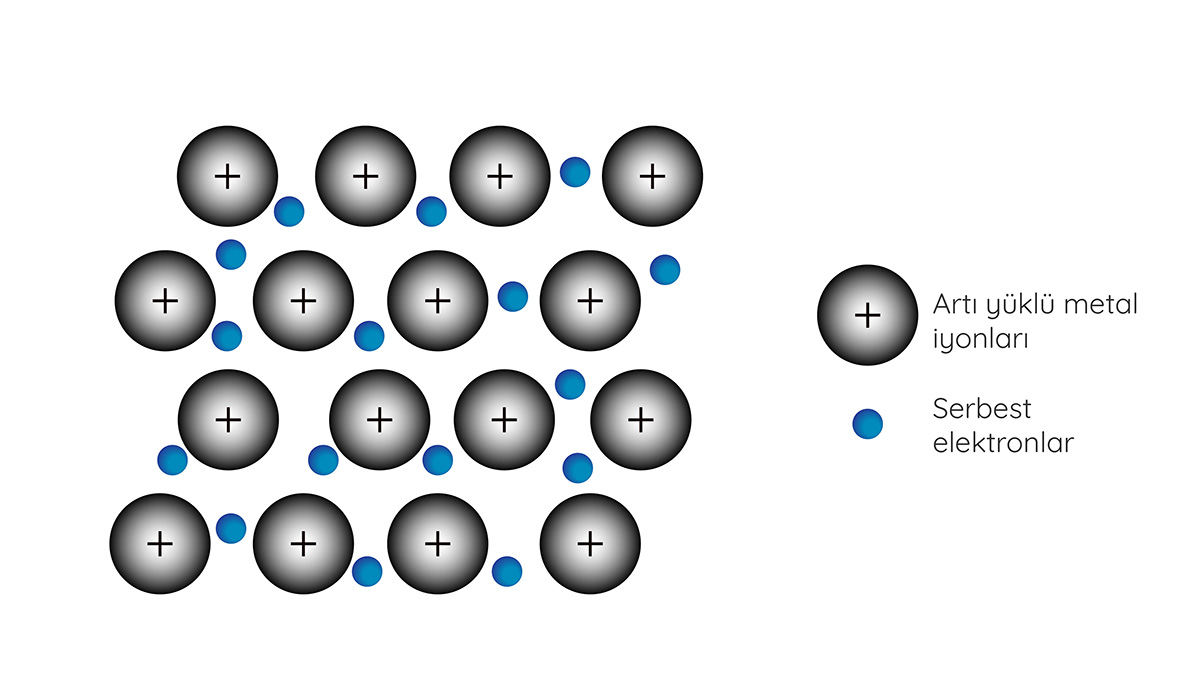
Jonas Reuel / iStock
Metalik bağda, metal atomlarının değerlik elektronları serbest bir şekilde hareket edebilir.
Metalik bağ, metal atomları arasında ortaya çıkan bağ türüdür. Metallerin elektronegatiflikleri düşüktür. Yani bağ oluşumunda yer alan elektronlarını zayıf bir şekilde çekerler. Metal atomları bir arada bulunduklarında, en yüksek enerjili elektron kabuğundaki değerlik elektronları atomdan ayrılarak komşu metal atomlarının değerlik orbitallerinde serbest bir şekilde hareket edebilir. Serbest dolaşan değerlik elektronları bir tür elektron denizi oluşturur. Sonuçta artı yüklü metal iyonları ile serbest olarak dolanan değerlik elektronları arasındaki elektrostatik çekme kuvveti nedeniyle metalik bağ ortaya çıkar.

Niteenrk / iStock
Metaller serbest hareket edebilen değerlik elektronları sayesinde dövülerek şekillendirilebilir.
Metallerin erime ve kaynama sıcaklıklarının yüksek olmasının nedeni metalik bağlardır. Çünkü atomlar arasındaki bağların güçlü olması, erime ve kaynama sıcaklıklarının yüksek olmasına neden olur. Ayrıca metallerin renklerinin parlak olması, dövülerek şekillendirilebilmeleri, ısı ve elektriği iyi iletmeleri gibi özelliklerinin nedeni, serbest olarak hareket edebilen değerlik elektronlarıdır.
En Güçlü Kimyasal Bağ Hangisidir?
Kimyasal bağlar arasında en güçlü olanı, artı yüklü metal iyonları ile elektron denizinde hareket eden değerlik elektronları arasındaki çekim kuvveti nedeniyle ortaya çıkan metalik bağdır. Ardından eksi ve artı yüklü iyonların elektrostatik olarak birbirini çekmesi sonucu oluşan iyonik bağ gelir. İyonik bağı polar kovalent bağ takip eder. Kısmen artı yüklü atom ile kısmen eksi yüklü atom arasında oluşan çekim kuvveti nedeniyle polar kovalent bağ, apolar kovalent bağdan daha güçlüdür.
Kaynaklar:
- https://www.khanacademy.org/science/class-11-chemistry-india/xfbb6cb8fc2bd00c8:in-in-states-of-matter/xfbb6cb8fc2bd00c8:in-in-intermolecular-forces/a/intramolecular-and-intermolecular-forces
- https://ogmmateryal.eba.gov.tr/panel/panel/EKitapUniteOnizle.aspx?Id=171&sayfa=122
- https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Introduction_to_General_Chemistry_(Malik)/03:_Compounds/3.09:_Intramolecular_forces_and_intermolecular_forces